
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соляная и разбавленная серная кислоты растворяют данные металлы с образованием двухвалентных солей
|
|
|
|
На примере железа в таблицы 24.1 приведен системный анализ основных классов неорганических соединений.
Таблица 2. Основные классы соединений железа
Элементы триады железа
В триаду железа входят: железо(Fе), кобальт (Со) и никель(Ni). Это основные конструкционные металлы.Электронные конфигурация данных атомов имеют соответственно вид: 3d64s2. 3d74s2. 3d84s2. Наиболее устойчивые степени окисления для железа +2, +3 и +6, а для кобальта и никеля +2, +3.
Для железа наиболее устойчива при обычных условиях степень окисления +3, поэтому соединения железа +2 являются сильными восстановителями, а +6 – сильными окислителями. Для кобальта и никеля наиболее устойчива степень окисления+2, а в степени окисления +3 они обладают сильными окислительными свойствами.
В таблице 2 приведены основные классы соединений, образуемых железом.
| +2 | +3 | +6 | |
| Оксиды | FеО (основной) оксид железа (II) | Fе2О3 (амфотерный) оксид железа (III) | FеО3 (кислотный) оксид железа (VI) |
| FеО + Fе2О3 = Fe3О4 смешанный оксид | |||
| Гидроксиды | Fе(ОН)2 гидроксид железа (II) | Fе(ОН)3 гидроксид железа (III) НFеО2 мета-железистая кислота Н3FеО3 орто-железистая кислота | Н2FеО4 железная кислота
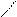 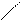  Н–О О Н–О О
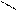 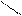 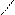 Fе
Н–О О Fе
Н–О О
|
| Соли | FеСl2 хлорид железа (II) | FеСl3 хлорид железа (III) К3СrО3 – феррит калия | К2FеО4 феррат калия |
Железо, кобальт и никель - активные металлы, находящийся в ряду напряжений до водорода. На воздухе окисляются с образованием соответствующих оксидов. Накаленное железо сгорает по реакции
4Fe + 3О2 = Fe2О3.
В мелкораздробленном состоянии (диаметр частиц около 5 мкм ) самовоспламеняются на воздухе, т.е. обладают пирофорными свойствами.
Железо при температуре красного каления (~500 0С) окисляется водой
3Fe + 4Н2О = Fe2О3 + H2.
Оксид железа (II) FeO и соответствующий ему гидроксид Fe(OH)2 обладают основными свойствами; оксид железа (III) Fe2О3 проявляет амфотерные свойства растворяется в кислотах, а при сплавлении со щелочами образует соли железистой кислоты - метаферриты:
Fe2О3 + 6 НС1 = 2 FeCl3 + 3 Н2О;
Fe2О3 + 2 NaOH = 2NaFeО2 + H2О.
Смешанный оксид железа (II, III) – Fe3О4 можно рассматривать как соль, образованную при взаимодействии основного оксида (FeO) и амфотерного оксида(Fe2О3) с образованием соли Fe(FeО2)2 - метаферрит железа (II). Структурную формулу данной соли можно представить следующим образом
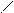 О – Fe = О
О – Fe = О
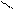 Fe
Fe
О – Fe = О
Соединения железа (II) проявляют восстановительные свойства и легко окисляются до соединений железа (III). Например, белый гидроксид железа (II) уже в момент осаждения из растворов принимает зеленоватую окраску вследствие частичного окисления кислородом воздуха, а затем зелёный цвет изменяется на бурый в результате полного окисления Fe(OH)2 до Fe(OH)3
4 Fe(OH)2 + O2 + 2 Н2О = 4 Fe(OH)3.
Данная реакция используется для обезжелезивания воды.
Fe + 2НCl = FeCl2 + Н2.
При растворении железа в азотной или концентрированной серной кислотах при обычных условиях или при нагревании образуются соли железа (III):
Fe + 4НNO3(разб.) → Fe(NO3)3 + NO + 2Н2О,
2 Fe + 6 H2SО4 = Fe2(SО4)3 + 3 SО2↑ + 6 H2О.
Концентрированная азотная кислота, содержанная NO2, и концентрированная (близкая к 100%) серная кислота пассивирует данные металлы, создавая на их поверхности оксидные пленки.
Ионы Fe3+ проявляют относительно сильные окислительные свойства φ°(Fe3+/ Fe2+) = +0,77 В. На практике это используется для «травления» печатных плат по реакции:
2 FeCl3 + Сu = 2 FeCl2 + CuCl2.
Ионы Fe2+ и Fe3+ - являются комплексообразователи. Наиболее устойчивы цианидные комплексы:
1) К4[Fе(СN)6] – гексацианоферрат (II) калия («жёлтая кровяная соль») является чувствительным реактивом на ионы Fе3+
FeCl3 + K4[Fe(СN)6] → KFe[Fe(СN)6] + KCI.
Образующийся малорастворимый гексацианоферрат(П) калия-железа(Ш) имеет интенсивно синий цвет. Это соединение часто называют «берлинской лазурью».
2) Кз[Fе(СN)6] – гексацианоферрат(III) калия («красная кровяная соль») является чувствительным реактивом на ионы Fе2+
FeCl2 + K3[Fe(СN)6] → KFe[Fe(СN)6] + 2KCI.
Образующийся осадок гексацианоферрат(Ш) калия-железа(И) окрашен в интенсивно синий цвет; его часто называют «турнбулевой синью».
Соединения железа (VI) - ферраты - очень сильные окислители
2 K2FeО4 + 16 НС1 = 2 FeCl3 + 3 Cl2↑ + 4 KCI + 8 H2О.
Качественной реакцией на трехвалентное железо является взаимодействие его с роданидом калия или аммония
FeCl3 + 3 KCNS ® Fe(CNS)3 + 3 KCl.
Железо образует с СО летучую жидкость пентакарбонил железа Fe(СО)5, которая при нагревании разлагается на СО и порошкообразное высокочистое железо.
При обработке поверхности железа азотом (азотировании) оно приобретает твердость и коррозионную стойкость. С углеродом железо образует прочное соединение цементит Fe3С. Большое практическое значение имеют соединения железа, кобальта и никеля с кремнием и бором, которые придают сплавам: твердость, прочность при высокой температуре и коррозионную стойкость.
Соли кобальта (II) в безводном состоянии обычно синего цвета, а их водные растворы и кристаллогидраты имеют розовую окраску. Фильтровальная бумага, пропитанная раствором хлорида кобальта(II) и затем высушенная, может служить грубым гигрометром (указателем влажности), так как в зависимости от содержания влаги в воздухе он принимает разные оттенки цветов от синего до розового.Соединения никеля сходны с соединениями кобальта.
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 608; Нарушение авторских прав?; Мы поможем в написании вашей работы!