
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Всего углерода в газы
|
|
|
|
Уравнение реакции в общем виде:

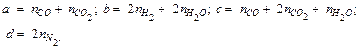
Между продуктами разложения идет обратимая реакция (реакция водяного газа):

Выражая концентрации компонентов водяного газа через искомые величины  согласно учению о химическом равновесии:
согласно учению о химическом равновесии:

где – константа равновесия реакции водяного газа.
– константа равновесия реакции водяного газа.
Константы равновесия могут быть выражены через равновесные концентрации реагирующих веществ ( ) или через равновесные парциальные давления (
) или через равновесные парциальные давления ( ). Если считать продукты превращения идеальным газом, то для реакции
). Если считать продукты превращения идеальным газом, то для реакции  можно вывести:
можно вывести:

где 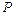 – общее давление аппаратов взрыва;
– общее давление аппаратов взрыва;
 ,
, 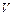 ,
, 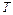 – соответственно общее число молей, объём и температура этих продуктов, а
– соответственно общее число молей, объём и температура этих продуктов, а 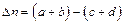 .
.
Таким образом для того чтобы определить  по таблице надо знать T, а чтобы вычислить Т надо знать состав продуктов взрыва. Задаются Т и определяют
по таблице надо знать T, а чтобы вычислить Т надо знать состав продуктов взрыва. Задаются Т и определяют  и решают уравнение. Определив
и решают уравнение. Определив  вычисляют Т.
вычисляют Т.
При расчёте мы принимали, что равновесие реакции водяного газа зависит только от температуры. При слишком высоких давлениях вместо парциального давления в  подставляются их фугативности.
подставляются их фугативности.
Отношение фугативности газа к его парциальному давлению называют коэффициентом активности. По определению
 , (4.1)
, (4.1)
где  ,
,  ,
,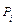 – соответственно коэффициенты активности, фугативности и парциальное давление
– соответственно коэффициенты активности, фугативности и парциальное давление  - го компонента газовой смеси.
- го компонента газовой смеси.
Из курса термодинамики известно:
 ,
,
где 
Можно показать, что:

Заменяя в выражении константы равновесия водяного газа давления на фугативности, с учетом (4.1) имеем:
 ,
,
или  через G, получим:
через G, получим:
 ,
,
G – обозначает поправочный множитель.
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 291; Нарушение авторских прав?; Мы поможем в написании вашей работы!