
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Принцип действия
|
|
|
|
Кислотные аккумуляторы.
Аккумуляторы.
Химические источники.
Химические источники преобразуют химическую энергию в электрическую, при этом происходит расход активных веществ из которых состоит источник (разряд).
Химические источники подразделяются на: первичные – гальванические, вторичные – аккумуляторы.
Гальванические элементы являются приборами однократного действия, т.е. в конце разряда, когда активные вещества будут израсходованы, они подлежат замене.
Аккумуляторы при заряде, подключаются к внешнему источнику постоянного тока. При этом электрическая энергия переходит в химическую энергию и снова образуются активные вещества. Аккумулятор является источником многократного действия (в средним 1000 циклов заряд-разряд).
В зависимости от типа применяемых активных веществ аккумуляторы бывают двух типов: кислотные (кислотно-свинцовые) и щелочные.
В качестве электролита используется серная кислота.
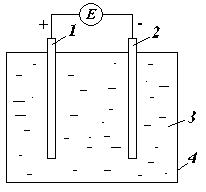
1 – положительная пластина PbO2.
2 – отрицательная пластина Pb.
3 – электролит (раствор серной кислоты).
4 – сосуд из кислотоупорного материала.
Рассмотрим процессы, которые происходят в аккумуляторах при разряде:
Молекулы серной кислоты распадаются, диссоциируют на положительные ионы водорода и отрицательные ионы кислотного остатка, при этом положительные ионы перемещаются к положительной пластине, а отрицательные ионы к отрицательной пластине.
Ионы отдают свой заряд пластине, нейтрализуются и вступают в реакцию с материалом пластины. При этом на положительной пластине происходит реакция:
PbO2 + 2H + H2SO4 = PbSO4 + 2H2O
На отрицательной пластине более простая реакция:
Pb + SO4 = PbSO4
Из реакции следует:
1. Активная масса как положительной, так и отрицательной пластины превращается в сульфат свинца;
2. В процессе разряда расходуется серная кислота и образуется вода, следовательно плотность электролита будет уменьшаться, это имеет большое практическое значение, т.е. измеряя плотность электролита определяют степень разряда кислотного аккумулятора.
При заряде к электродам подключается внешний источник, между пластинами создаётся электрическое поле. Движение ионов, под действием поля идет в обратном направлении и химические реакции идут в обратном направлении. При этом активная масса пластин восстанавливается до первоначального химического состава, а плотность электролита возрастает до первоначального состояния.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 345; Нарушение авторских прав?; Мы поможем в написании вашей работы!