
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Правило Хунда
|
|
|
|
Принцип Паули (принцип запрета)
В атоме не может быть двух электронов с одинаковым набором квантовых чисел.
Согласно принципу Паули на одной орбитали, характеризуемой тремя квантовыми числами п, l, ml могут находиться только два электрона, отличающиеся значением спинового квантового числа.
На первом, состоящем из одной s-орбитали энергетическом уровне могут находиться только два электрона, на втором уровне, включающем одну s- и три р-орбитали, могут находиться 2+6=8 электронов.
На третьем уровне, состоящем из одной s-, трех р- и пяти d- орбиталей, могут находиться 2 + 6 + 10 = 18 электронов.
На четвертом уровне максимальное число электронов равно 32.
Следствие из принципа Паули: максимально возможное число электронов на каждом энергетическом уровне равно
Nmax = 2n2
Энергетические уровни и подуровни, которые содержат максимальное число электронов, называются завершенными или замкнутыми.
Заполнение орбиталей в пределах одного подуровня осуществляется согласно правилу Хунда.
Данный энергетический подуровень электроны стремятся заполнить таким образом, чтобы суммарный спин их был максимальным.
Например, электронная формула углерода С: 1s2 2s2 2р2. Распределяем р -электроны по квантовым ячейкам:
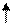
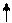







 первый вариант m s = 1/2 + 1/2 = 1;
первый вариант m s = 1/2 + 1/2 = 1;
второй вариант m s = 1/2 - 1/2 = 0.
Первый вариант правильный, т.к. суммарный спин максимальный.
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 579; Нарушение авторских прав?; Мы поможем в написании вашей работы!