
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Взаимодействие между молекулами
|
|
|
|
1.4. 1. Вандерваальсовы силы: ориентационная, индукционная и дисперсионная составляющие. Модель Лондона
Молекула - химически устойчивое и электрически нейтральное образование. Однако химическая устойчивость отдельной молекулы относительна и проявляется на расстояниях, значительно превышающих размеры самой молекулы.
Уже на расстоянии порядка 1нм между молекулами возникают силы притяжения (вандерваальсовы силы). При этом их электронные облака не перекрываются, химическая связь не образуется. На расстояниях значительно меньших, чем 1нм возможны перекрывания электронных облаков с образованием новых молекул. Возникающие при этом связи могут иметь различную прочность. Относительно малую прочность имеют водородные связи; более высокую прочность имеют химические связи между молекулами, образованными по и донорно-акцепторному механизму.
Слабое взаимодействие между нейтральными молекулами на расстояниях, значительно превосходящих их размеры, было впервые экспериментально обнаружено голландским ученым Ван-дер-Ваальсом. Этим силам приписывают электростатическую природу и обычно выделяют три их составляющие: ориентационную, индукционную и дисперсионную.
Ориентированная (диполь-дипольная) составляющая представляет собой электростатическое взаимодействие соответствующим образом ориентированных диполей, т. е. полярных молекул.

Энергия ориентационного взаимодействия возрастает с увеличением электрического момента диполя молекулы и уменьшается с ростом температуры, т.к. тепловое движение молекул нарушает ориентацию диполей и соответственно снижает энергию их взаимодействия.
Эта составляющая сил Ван-дер-Ваальса проявляется только в системе, состоящей из полярных молекул.
Индукционная составляющая проявляется в системах, состоящих из полярных и неполярных молекул. Под действием электрического поля полярной молекулы в неполярной молекуле происходит наведение (индукция) электрического поля, т.е. неполярная молекула, поляризуется под действием электрического поля полярной молекулы.
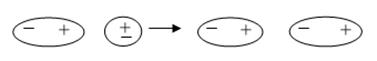
Энергия индукционного взаимодействия будет возрастать с ростом электрического момента диполя полярной молекулы, но не будет зависеть от температуры, поскольку наведение диполя в неполярной молекуле определяется суммарным электрическим полем полярных молекул, окружающих данную, т.е. наведение диполя в неполярной молекуле происходит при любой пространственной ориентации молекул.
Межмолекулярное взаимодействие не исчерпывается ориентационной и индукционной составляющими. Известно большое количество таких веществ, как благородные (Не, Ne, Ar и т.д.) или простые (О2, Н2,,N2 и т.д.) газы, молекулы которых одноатомны или неполярны соответственно, но которые могут быть получены в конденсированном состоянии.
Возникновение взаимодействия между подобными молекулами было впервые объяснено немецким ученым Ф. Лондоном (модель Лондона). Он показал, что электростатическое отталкивание между электронами двух каких-либо атомов или молекул снижается, если движение электронов в них происходит таким образом, что электроны все время оказываются максимально удаленными друг от друга. При таком согласованном движении электронов каждый из атомов представляет собой "мгновенный" диполь, положительный полюс которого расположен в ядре атома, а отрицательный - в точке нахождения электрона.
 |
При таком согласованном движении электронов "мгновенные" диполи ориентируются разноименно заряженными концами, в результате чего происходит их электростатическое притяжение.
Модель Лондона позволила определить среднюю статистическую величину всех подобных взаимодействий, получившую название дисперсионной составляющей сил Ваи-дер-Baaльca, которая действует между любыми атомами или молекулами независимо от их строения.
Энергия дисперсионной составляющей будет возрастать с увеличением эффективного радиуса взаимодействующих атомов или молекул, поскольку при этом растет величина поляризуемости атомов или молекул.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1107; Нарушение авторских прав?; Мы поможем в написании вашей работы!