
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ионные кристаллы
|
|
|
|
Кристаллические решетки кристаллов этого типа состоят из чередующихся положительно и отрицательно заряженных ионов, между которыми действуют электростатические силы притяжения. Ионный кристалл нужно рассматривать как одну гигантскую молекулу, в которой каждый ион испытывает воздействие со стороны всех остальных.
Кристаллическая решетка NaCl приведена на рисунке 1.16.
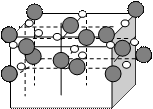
Рис.1.16
Ионные кристаллы образуются при взаимодействии атомов, имеющих большую разность электроотрицательностей. Примерами ионных кристаллов являются галогениды (NaСl, KF), гидриды (NaН) щелочных или щелочно-земельных (СаF2, СаН2) металлов, оксиды и карбиды 1-2 групп, главных подгрупп (Na2О, СаО, К2С2, СаС2).
В состав ионных кристаллов могут входить и сложные ионы: NО-3, SO2-4, в анионах которых ковалентная связь.
Координационное число в ионных кристаллах зависит от соотношения радиуса катиона и аниона.
Корд. число RК / RА
CsCl 8 > 0,73
NaCl 6 < 0,73 - 0,41
ZnS 4 < 0,41
Энергия кристаллической решетки достигает высоких значений (для NaСl Е=770 кДж/моль); это, в свою очередь, обусловливает следующий набор физических свойств: высокую твердость, хрупкость, высокие температуры плавления и кипения, высокие теплоты плавления. Подобные свойства определены не только значительной энергией кристаллической решетки, но и структурой каркаса ионного кристалла.
Многие ионные кристаллы относят к классу диэлектриков; при комнатной температуре их электропроводность на 20 порядков ниже, чем электропроводность металлов. С увеличением температуры электропроводность ионных кристаллов возрастает. В водных растворах и расплавах они являются проводниками второго рода.
Во многих ионных кристаллах наряду с электростатическим притяжением действуют ковалентные связи, а также силы Ван-дер-Ваальса, причем присутствие ковалентной связи вызывает определенные отклонения в физико-химических свойствах кристаллов этого типа, которые не объясняются электростатической моделью.
Наименьшее влияние ковалентности наблюдается для кристаллов галогенидов щелочных металлов.
Так как ионная связь не имеет направленного характера, а многим ионам можно приписать сферическую форму, то структура большинства ионных кристаллов тождественна структурам плотнейшей упаковки.
Вещества ионной природы с многоатомными ионами также образуют ионные кристаллы. Это наблюдается даже для таких ионов, как SO2-3, которые имеют тригональную симметрию.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 680; Нарушение авторских прав?; Мы поможем в написании вашей работы!