
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основания
|
|
|
|
Основаниями с позиций теории электролитической диссоциации являются вещества, диссоциирующие в растворах с образованием гидроксид - ионов OH ‾ и ионов металлов (исключение NH4OH).
Основания классифицируют по их силе (по способности к электролитической диссоциации – на сильные и слабые), по кислотности (по количеству гидроксогрупп в молекуле, способных замещаться на кислотные остатки – на однокислотные, двукислотные и т. д.), по растворимости (на растворимые основания – щелочи и нерастворимые). Например: NaOH – сильное, однокислотное основание, растворимое (щелочь); Cu(OH)2 – слабое, двукислотное, нерастворимое основание. К растворимым основаниям (щелочам) относятся гидроксиды щелочных и щелочноземельных металлов. К сильным основаниям относятся все щелочи.
Химические свойства оснований:
1. Взаимодействие с кислотами:
Ca(OH)2 + H2SO4 = CaSO4 ¯ + H2O.
2. Взаимодействие с кислотными оксидами:
Ca(OH)2 + CO2 = CaCO3 + H2O.
3. Взаимодействие с амфотерными оксидами:
2KOH + Al2O3 = 2KAlO2 + H2O 1,
2KOH + SnO + H2O = K2[ Sn(OH)4 ].
4. Взаимодействие с амфотерными основаниями:
2NaOH + Zn(OH)2 = Na2ZnO2 +2H2O2,
2NaOH + Zn(OH)2 = Na2[ Zn(OH)4 ]3.
5. Термическое разложение оснований с образованием оксидов и воды:
Ca(OH)2  =
= CaO + H2O.
CaO + H2O.
Гидроксиды щелочных металлов при нагревании не распадаются.
6. Взаимодействие с амфотерными металлами (Zn, Al, Pb, Sn, Be):
Zn + 2NaOH + 2H2O = Na2 [Zn(OH)4] + H2↑
Амфотерные гидроксиды. Амфотерные гидроксиды (гидраты амфотерных оксидов) способны диссоциировать в водных растворах как по типу кислот, так и по типу оснований. Например:
ZnO22- + 2H+ Û Zn(OH)2 Û Zn2+ + 2OH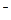 .
.
Поэтому они обладают амфотерными свойствами, т.е. могут взаимодействовать как с кислотами, так и с основаниями:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O,
Sn(OH)2 + 2NaOH = Na2[ Sn(OH)4 ].
Номенклатура оснований. Названия оснований строятся из слова “ гидроксид ” и названия металла в родительном падеже с указанием в скобках римскими цифрами его степени окисления, если это величина переменная. Иногда к слову гидроксид добавляют префикс из греческого числительного, указывающий на число гидроксогрупп в молекуле основания. Например: KOH - гидроксид калия; Al(OH)3 - гидроксид алюминия (тригидроксид алюминия); Cr(OH)2 – гидроксид хрома (II) (дигидроксид хрома).
|
|
|
|
|
Дата добавления: 2013-12-11; Просмотров: 394; Нарушение авторских прав?; Мы поможем в написании вашей работы!