
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электродные потенциалы
|
|
|
|
ОСМОС
Энтропия - единственная функция состояния, абсолютное значение которой известно. По постулату Планка (третье начало термодинамики) при T = 0 K энтропия идеального кристалла равна 0.
Подавляющее большинство реальных химических систем не являются изолированными, так как могут обмениваться с внешней средой теплотой и работой. Для определения возможности самопроизвольного протекания химических процессов вводятся еще две функции состояния:
1) для изобарно-изотермических условий - энергия Гиббса (G):
при p = const, T = const G = H - TS
2) для изохорно-изотермических условий - энергия Гельмгольца (F):
при V = const, T = const F = U - TS
На практике обычно используется энергия Гиббса, так как условия, близкие к изобарно-изотермическим, встречаются чаще.
Изменение энергии Гиббса (DG) в ходе химической реакции рассчитывается по уравнению:
DG = DH - T DS
Проще всего это сделать для стандартных условий, так как величины G°, H°, S° образования многих веществ приведены в специальных таблицах. Если условия сильно отличаются от стандартных (T=298K, p=1,013.105 Па), то необходимо знать экспериментальные зависимости DH = f(T,p) и DS = f(T,p).
Из второго начала следует, что в закрытой системе (т.е. системе, которая может обмениваться с внешней средой теплом, но не может обмениваться с ней веществом) процесс может протекать самопроизвольно, если DG < 0. Процессы, для которых расчет показывает DG > 0, в закрытой системе сами по себе идти не могут (они осуществимы только при действии на систему внешних сил).
Выполнение условия DG < 0 еще не означает, что данный процесс будет наблюдаться в действительности. Многие химические реакции и фазовые переходы при относительно низких температурах (например, комнатной) протекают со скоростью, близкой к нулю. Все самопроизвольные процессы протекают в сторону уменьшения энергии Гиббса, и система стремится к состоянию термодинамического равновесия (G = Gmin, DG = 0).
ТЕМА 5. ОБЩИЕ СВОЙСТВА РАСТВОРОВ
Раствор - это гомогенная (однородная) система, состоящая из двух или более компонентов (химических веществ).
Один из компонентов считается растворителем, а остальные - растворенными веществами. Если вещества до смешивания находились в разных агрегатных состояниях, то растворителем считается тот компонент, агрегатное состояние которого имеет раствор. Например, при смешивании жидкой воды и твердого сахара получился жидкий раствор. В данном случае растворителем является вода, а сахар - растворенным веществом.
Если вещества в момент смешивания имели одинаковое агрегатное состояние, то растворителем считается тот компонент, которого больше по количеству вещества.
По агрегатному состоянию растворы можно разделить на газообразные, жидкие и твердые.
Способы выражения концентрации растворов
I. Массовая доля (w) - это отношение массы растворенного вещества к общей массе раствора:
w (X) = 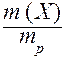 ;
;
Массовая доля - безразмерная величина. Сумма массовых долей всех веществ в растворе = 1. Массовая доля может быть выражена в процентах. В этом случае она находится по формуле:
w (X) = 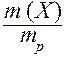 × 100 %,
× 100 %,
II. Мольная доля (х) - отношение количества вещества Х (моль) к общему числу молей всех веществ в растворе.
х (Х) = 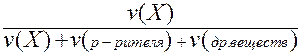 .
.
Массовая доля - безразмерная величина. Сумма мольных долей всех веществ в растворе = 1.
III. Массовая концентрация (Т) - отношение массы компонента Х к объему раствора.
Т(Х) = 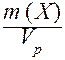 .
.
Обычно Т находят в единицах (г/дм3), в системе СИ она имеет единицу измерения (кг/м3). В аналитической химии эта величина выражается в единицах (г/см3) и называется титром вещества Х.
IV. Молярная концентрация (молярность) c(Х) или [X] - отношение количества вещества к объему раствора.
c(Х) = [X] = 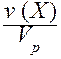 .
.
Обычно молярность выражают в (моль/дм3) и обозначают буквой (М). В системе СИ молярность имеет единицу измерения моль/м3.
V. Моляльность (b) - отношение количества вещества Х к массе растворителя в данной порции раствора.
b(X) = 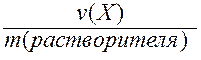 .
.
Моляльность может иметь только одну единицу измерения - моль/кг.
VI. Молярная концентрация эквивалента c(Э) - отношение количества вещества эквивалента к объему раствора:
c(Э) = c( X) =
X) = 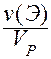 =
= 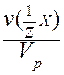 =
= 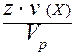 .
.
Ранее для обозначения этого понятия использовались синонимы: эквивалентная концентрация, нормальная концентрация, нормальность (все они считаются устаревшими).
Молярная концентрация эквивалента обычно выражается в единицах моль/дм3. В СИ она имеет единицу измерения моль/м3.
Коллигативные свойства растворов
Некоторые физико-химические свойства разбавленных растворов не зависят от природы растворенного вещества, а определяются только количеством частиц этого вещества в растворе и природой растворителя. Такие свойства называются коллигативными.
Математические зависимости для коллигативных свойств выведены для сильно разбавленных растворов неэлектролитов. В случае электролитов в эти формулы вводится поправочный коэффициент, который называется изотоническим коэффициентом (i):
i = 1 - a (1 - n),
где a - степень электролитической диссоциации электролита; n - число ионов, на которые распадается каждая молекула электролита.
В ходе экспериментальных исследований жидких растворов широко используются полупроницаемые перегородки (осмотические мембраны).
Осмотическая мембрана изготавливается из материала, который пропускает через себя только молекулы растворителя. Молекулы растворенного вещества не могут проходить через нее. В современных приборах по измерению осмотического давления (осмометрах) осмотические мембраны изготавливаются из специальных сортов целлофана.
Для объяснения явления осмоса рассмотрим схему (рис. 1а).
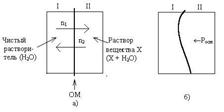
Некий сосуд разделен на две части осмотической мембраной (ОМ), выполненной из эластичного материала (типа очень тонкой резины). В начальный момент времени в левой части сосуда (I) находится чистый растворитель (например, вода), а в правой части сосуда (II) находится раствор вещества Х в данном растворителе (например, сахара в воде).
Концентрация молекул Н2О в чистом растворителе всегда больше, чем в растворе. Поэтому поток молекул воды через мембрану из левой части сосуда в правую (n1) будет больше, чем обратный поток (n2). Это приведет к тому, что объем I будет уменьшаться, а объем II увеличиваться. Эластичная осмотическая мембрана выгнется влево (рис. 1б).
Получается, что со стороны раствора на мембрану действует давление, которое деформирует эту перегородку. Такое давление называется осмотическим (Росм). Величина его определяется уравнением Вант-Гоффа:
Pосм = c(Х)RT,
где С(Х) - молярная концентрация вещества Х в растворе; R - универсальная газовая постоянная (8,31 Дж / моль × К); T - температура раствора (К).
Данное выражение по форме аналогично уравнению Менделеева - Клайперона для идеального газа:
PV = 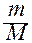 RT = v RT,
RT = v RT,
P = cRT.
Поэтому Вант-Гофф сформулировал закон осмотического давления следующим образом: осмотическое давление равно тому давлению, которое производило бы растворенное вещество, если бы оно в виде идеального газа занимало тот же объем при той же температуре.
Измерение осмотического давления - один из главнейших методов определения молярных масс высокомолекулярных веществ (каучук, целлюлоза, белки, жиры и т.п.).
ЗАКОН РАУЛЯ
Если жидкий летучий растворитель (например, воду) поместить в замкнутый объем, то через некоторое время установится равновесие (рис. 2).
Н2О(ж) 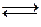 Н2О(г)
Н2О(г)
Равновесное давление паров воды (Р0) называется давлением насыщенного пара над чистым растворителем. Величина Р0 зависит только от природы растворителя (Н2О) и температуры. Если в воде при той же температуре растворить некоторое количество нелетучего вещества Х (например, сахара), то давление паров растворителя понизится на величину DР = Р0 - Р, где Р - давление паров растворителя над данным раствором. Величина 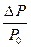 называется относительным понижением давления пара над раствором.
называется относительным понижением давления пара над раствором.
Закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором нелетучего вещества равно мольной доле этого вещества в растворе.
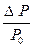 = x (X).
= x (X).
В экспериментальных исследованиях часто используются 2 следствия из закона Рауля.
Первое следствие из закона Рауля: раствор нелетучего вещества имеет температуру кипения выше, чем у чистого растворителя.
D Тк = Тр - Т0 = Кэ × b (X),
где D Тк - увеличение температуры кипения раствора по сравнению с чистым растворителем;
Тр - температура кипения раствора вещества Х;
T0 - температура кипения чистого растворителя;
b (X) - моляльность раствора (моль / кг растворителя);
Kэ - эбулиоскопическая константа.
Значение Кэ определяется только природой растворителя: для воды Кэ = 0,52 кг × К / моль, для бензола Кэ = 2,57 кг × К / моль, для этилового спирта Кэ = 1,16 кг × К / моль, для диэтилового эфира Кэ = 2,02 кг × К / моль и т.д.
Измерив температуру кипения раствора неизвестного вещества в данном растворителе, можно рассчитать его молярную массу. Этот метод называется эбулиоскопией.
Второе следствие из закона Рауля: раствор нелетучего вещества имеет температуру замерзания ниже, чем у чистого растворителя:
DTз = Т0 - Тр = Кк × b (X),
где D Тз - понижение температуры замерзания раствора по сравнению с чистым растворителем;
T0 - температура замерзания чистого растворителя;
Tр - температура замерзания раствора вещества Х;
b (X) - моляльность раствора (моль / кг растворителя).
Значение Кк для данного растворителя является константой:
Кк (Н2О) = 1,86 кг × К / моль, Кк (бензол) = 5,1 кг × К / моль, Кк (диэтиловый эфир) = 1,73 кг × К / моль.
На этом следствии из закона Рауля основана криоскопия: метод нахождения молярных масс веществ, исходя из измерения температуры замерзания их растворов.
ТЕМА 6. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Было установлено, что многие вещества, при растворении в полярных растворителях (например, в воде) распадаются на ионы. Такие вещества называются электролитами, а процесс распада на ионы называется электролитической диссоциацией (ЭД).
Электролитическая диссоциация является следствием взаимодействия вещества с молекулами растворителя. В ходе этого процесса образуются ионы, окруженные молекулами растворителя - так называемой сольватной оболочкой (если растворителем является вода, оболочка называется гидратной). Ион вместе с сольватной оболочкой называется сольватированным (в случае воды - гидратированным или акватированным).
Основной количественной характеристикой процесса ЭД является степень электролитической диссоциации (точнее: истинная степень ЭД). Степень электролитической диссоциации (a) - это отношение числа молекул данного вещества, распавшихся на ионы (np) к общему числу молекул в данном растворе (n0):
a = 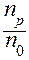 .
.
В соответствии со значениями a все вещества по отношению к данному растворителю можно разделить на 3 типа:
1) a = 0 неэлектролиты, 2) 0 < a < 1 cлабые электролиты, 3) a = 1 cильные электролиты.
Теория сильных электролитов
По определению, для сильных электролитов истинная степень диссоциации a = 1. И, действительно, в их растворах не обнаружено целых (недиссоциированных) молекул.
Несмотря на это многие экспериментальные методы исследования степени диссоциации (самый простой основан на измерении электропроводности растворов) дают значения этой величины меньше 1.
Экспериментальное значение степени диссоциации сильного электролита называется кажущейся степенью ЭД (aк), причем всегда aк < a = 1 (a - истинная степень ЭД).
Кажущаяся степень ЭД зависит от концентрации сильного электролита в растворе (чем больше концентрация, тем меньше aк).
Несоответствие между a и aк объясняется взаимодействием сольватированных ионов электролита с образованием ионных пар.
Рассмотрим, например, явления происходящие в водном растворе хлорида натрия. Как и любой другой сильный электролит, твердый NaCl переходит в раствор только в виде ионов (Na+ и Cl-). Ионы эти гидратированы (окружены диполями молекул воды)
Внешняя поверхность гидратной оболочки имеет тот же по знаку заряд, что и центральный ион. Сольватированные катион и анион в результате столкновения друг с другом могут образовывать неустойчивую квазичастицу: Na+(aq) × Cl- (aq). Эта квазичастица называется ионной парой. Ионные пары довольно легко разрушаются при соударении с другими частицами. Описанные выше явления можно изобразить в виде схемы:
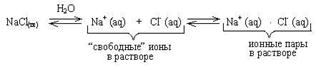
Если через раствор NaCl пропускать электрический ток, то ионные пары, как частицы в целом электронейтральные, не будут участвовать в электропроводности. Дальнейший расчет дает значение степени ЭД меньше 1. Понятно, что при увеличении концентрации увеличивается количество ионов в растворе, а значит усиливается ион-ионное взаимодействие с образованием ионных пар. Это приводит к уменьшению aк.
Во многих физических и химических процессах ионные пары ведут себя подобно “молекулам”, хотя, конечно, таковыми не являются. В ионной паре нет химической связи между центральными ионами, взаимодействуют только их гидратные оболочки.
Для учета отмеченных выше явлений вводится понятие об активности иона. Активность равна концентрации свободных ионов данного вида в растворе. Например, для ионов натрия:
a (Na+) = fa × [Na+],
где а (Na+) - активность ионов натрия;
fa - коэффициент активности ионов;
[Na+] - общая молярная концентрация ионов Na+ в растворе
(как свободных, так и входящих в ионные пары).
Коэффициент активности (fa) показывает, какая часть ионов данного вида не входит в состав ионных пар, т.е. участвует в различных электрических и ионных процессах.
Для сильно разбавленных растворов коэффициент активности можно рассчитать. Сначала находится значение ионной силы раствора (J):
J = 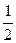 (
(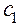
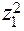 +
+ 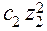 + ....
+ .... 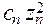 ),
),
где 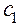 ,
, 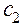 ....
.... 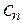 - молярные концентрации каждого из ионов в растворе;
- молярные концентрации каждого из ионов в растворе;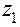 ,
, 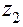 ....
.... 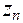 - их заряды.
- их заряды.
Коэффициент активности данного иона рассчитывается по уравнению:
lg fa = - 0,5 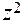
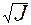 , где
, где 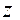 - заряд этого иона.
- заряд этого иона.
Теория слабых электролитов
Диссоциация любой частицы, являющейся слабым электролитом является обратимым процессом. Как и для любого другого обратимого процесса можно ввести понятие о константе равновесия, которая в данном случае получила название “константа диссоциации” (Кd). Например, угольная кислота является слабым электролитом и диссоциирует в две ступени (по второй ступени диссоциируют уже не молекулы Н2СО3, а гидрокарбонат-анионы НСО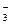 ):
):
1 cтупень: Н2СО3  Н+ + НСО
Н+ + НСО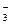
К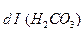 =
= 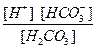
II ступень: HCO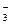
 H+ + CO
H+ + CO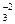
K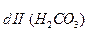 = Kd
= Kd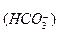 =
= 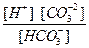
Общее уравнение: H2CO3  2H+ + CO
2H+ + CO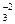
K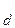 (общ) =
(общ) = 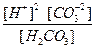
Нетрудно доказать, что К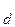 (общ) = К
(общ) = К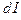 ×K
×K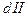 или
или
К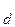 (общ) = К
(общ) = К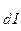 ×K
×K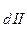 ×K
×K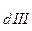 ×K
×K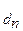 , где n - количество ступеней диссоциации слабого электролита.
, где n - количество ступеней диссоциации слабого электролита.
Используя принцип Ле-Шателье можно полагать, что К 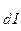 >> К
>> К 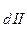 >> K
>> K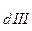 и т.д. И действительно, для всех слабых электролитов найдено, что константы диссоциации по (n - 1) - ой ступени на несколько порядков больше, чем таковая для n - ой ступени. Например, для угольной кислоты К
и т.д. И действительно, для всех слабых электролитов найдено, что константы диссоциации по (n - 1) - ой ступени на несколько порядков больше, чем таковая для n - ой ступени. Например, для угольной кислоты К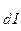 = 4,5 × 10-7, K
= 4,5 × 10-7, K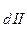 = 4,7 × 10-11.
= 4,7 × 10-11.
Величина константы диссоциации зависит только от природы элктролита и растворителя, а также от температуры. Значения К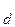 для различных веществ при определенной температуре (как правило, 25 °С) приведены в специальных справочных таблицах.
для различных веществ при определенной температуре (как правило, 25 °С) приведены в специальных справочных таблицах.
Константа диссоциации не зависит от концентрации электролита в растворе, а степень диссоциации (a) слабого электролита имеет явную зависимость от этого параметра: чем больше концентрация, тем меньше (a). Функционально эта зависимость описывается законом разбавления Оствальда:
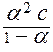 = K
= K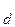 ,
,
где с - общая концентрация частиц электролита в растворе (моль/ дм3);
K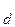 - константа диссоциации при данной температуре;
- константа диссоциации при данной температуре;
a - cтепень диссоциации.
При решении многих задач предполагается, что a << 1 (a ® 0):
Поэтому во многих случаях можно использовать упрощенную формулу:
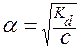 .
.
Она дает достаточно верный результат для значений a £ 0,1. Если же получается a > 0,1, то переходят к расчету по квадратному уравнению.
Ионные уравнения реакций
В качестве примера рассмотрим взаимодействие соляной кислоты и гидроксида натрия в водном растворе:
HCl + NaOH = NaCl + H2O.
Это уравнение написано в молекулярном виде. Молекулярное уравнение данного процесса не отражает реальных явлений, имеющих место при протекании такого взаимодействия, так как в приведенном примере все вещества, кроме воды, являются сильными электролитами и в растворе присутствуют не в виде молекул, а только в виде ионов:
HCl = H+ + Cl-,
NaOH = Na+ + OH-,
NaCl = Na+ + Cl-.
Поэтому уравнение нейтрализации логичнее написать в ионном виде. При переходе от молекулярного к ионному (точнее: полному ионному) уравнению на ионы разбиваются только формулы сильных электролитов, хорошо растворимых в воде:
H+ + Cl- + Na+ + OH- = Na+ + Cl- + H2O.
Полученное выражение можно сократить и получить сокращенное ионное уравнение:
H+ + OH- = H2O.
Сокращенное ионное уравнение показывает, что данное взаимодействие сводится к реакции между ионами водорода и гидроксид-анионами с образованием молекул слабого электролита (воды).
Аналогичным образом следует рассматривать и другие процессы, протекающие в растворах с участием электролитов.
ВОДОРОДНЫЙ И ГИДРОКСИЛЬНЫЙ ПОКАЗАТЕЛИ
Вода является очень слабым электролитом. Она диссоциирует по уравнению:
H2O  H+ + OH-.
H+ + OH-.
Для данного обратимого процесса можно написать выражение:
Kd (H2O) = 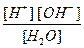 = 1,8 × 10-16 (при 22 °С).
= 1,8 × 10-16 (при 22 °С).
В данном выражении [H2O] равна концентрации молекул воды, не распавшихся на ионы. Так как на ионы распадается ничтожно малая часть молекул (a (H2O) = 1,8 × 10-7), то величину [H2O] можно считать постоянной и равной молярной концентрации чистой воды:
[H2O] = 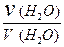 = 55,56 моль / дм3 = 55,56 М.
= 55,56 моль / дм3 = 55,56 М.
Полученное значение можно умножить на константу диссоциации и получить новую константу, которая называется константа воды (К):
K = [H2O] × Kd = 55,56 × 1,8 × 10-16» 1 × 10-14.
Константа воды определяет равновесные концентрации ионов Н+ и ОН- в водном растворе при данной температуре:
K = [H+] × [OH-] = 10-14 (при 22 °С).
Константа воды зависит только от природы воды и температуры.
В чистой воде [H+] = [OH-] = 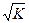 = 10-7 M. Такая среда называется нейтральной.
= 10-7 M. Такая среда называется нейтральной.
В водных растворах, содержащих кислоты [H+] > 10-7 M, а [OH-] < 10-7 M. Такая среда называется кислой. В растворах, содержащих основание [H+] < 10-7M, а [OH-] > 10-7M. Такая среда называется щелочной.
Для удобства пользуются не самими значениями концентраций ионов [H+] и [ОН-], а их отрицательными десятичными логарифмами, которые называются водородным показателем (рН) и гидроксильным показателем (рОН):
pH = - lg [H+],
pOH = - lg [OH-].
В нейтральной среде рН = 7; в кислой среде рН < 7, pOH > 7; в щелочной среде рН > 7, pOH < 7.
Если прологарифмировать уравнение [H+] [OH-] = 10-14, то можно показать, что:
рН + рОН = 14.
Характер среды в данном растворе можно качественно оценить с помощью специальных реактивов, которые называются кислотно-основными индикаторами. Точное определение рН (или рОН) растворов осуществляется специальными приборами (рН- метрами).
ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ
Произведение растворимости (ПР) является частным случаем константы равновесия для процесса перехода труднорастворимого сильного электролита в раствор.
Рассмотрим пример: в емкость с водой поместили кристаллический хлорид серебра (AgCl). Абсолютно нерастворимых веществ в природе не существует. Поэтому, несмотря на очень плохую растворимость, хлорид серебра начинает переходить в воду, причем в виде ионов Ag+ и Cl- (т.к. любая соль - сильный электролит). Растворение AgCl будет происходить до тех пор, пока не установится равновесие:
AgCl(тв)  Ag+ + Cl- (в растворе)
Ag+ + Cl- (в растворе)
После установления такого равновесия раствор будет называться насыщенным. Для данного обратимого процесса можно ввести константу равновесия:
Kp = 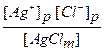 ,
,
где [Ag+]p и [Cl-]p - молярные концентрации соответствующих ионов в равновесном (насыщенном) растворе.
Концентрация [AgCl m ] является постоянной величиной. По сути дела это плотность твердого хлорида серебра, выраженная в единицах молярной концентрации (моль / дм3 = М). Поэтому вводится новая константа равновесия, которая называется произведением растворимости (ПР):
ПР(AgCl) = Kp × [ AgCl(m) ] = [Ag+]p × [Cl-]p.
ПР зависит только от природы веществ (электролита и воды) и температуры. ПР определяет произведение концентраций в насыщенном растворе. Если в каком-либо растворе произведение концентраций ПК = [Ag+] [Cl-] меньше ПР, то такой раствор является ненасыщенным. В нем можно растворить еще некоторое количество данного вещества (до насыщения: ПК = ПР).
Если же ПК > ПР, то раствор называется пересыщенным. Это тоже неравновесный раствор, так как избыточное количество растворенного вещества будет самопроизвольно выпадать в виде осадка до тех пор, пока ПК не станет равным ПР при этой температуре.
ГИДРОЛИЗ СОЛЕЙ
Гидролиз - это взаимодействие между частицами вещества, растворенного в воде и молекулами растворителя (воды).
Практически важен гидролиз солей. Любая соль является сильным электролитом, поэтому в водном растворе она существует только в виде ионов - катионов основного остатка и анионов кислотного остатка. Отсюда следует, что гидролиз соли сводится к обменному взаимодействию между ионами (катионами или анионами) и молекулами воды. Различают 3 случая гидролиза; гидролиз по катиону, гидролиз по аниону и совместный гидролиз по катиону и аниону одновременно.
1. Гидролиз по катиону
Гидролиз по катиону имеет место только в том случае, если в результате его протекания в растворе появляются частицы слабых электролитов (слабые основания или их основные остатки - гидроксокатионы). Так, например, сульфат натрия Na2SO4 не подвергается гидролизу по катиону (NaOH - сильный электролит), в то время как сульфат меди (II) CuSO4 гидролизуется по катиону.
При переходе в водный раствор CuSO4 полностью распадается на ионы:
CuSO4 = Cu+2 + SO .
.
Далее идет гидролиз иона Сu+2 по двум ступеням (первая ступень - гидролиз самого иона Cu+2, а вторая ступень - гидролиз его гидрокатиона):
I ступень гидролиза: Cu+2 + H2O  CuOH+ + H+.
CuOH+ + H+.
II ступень гидролиза: CuOH+ + H2O  Cu(OH)2 + H+.
Cu(OH)2 + H+.
Данные уравнения написаны в ионном виде. Можно написать и молекулярные уравнения гидролиза, хотя эта форма записи носит формальный характер, так как гидролиз соли - ионное взаимодействие:
I ступень: 2CuSO4 + 2H2O  (CuOH)2SO4 + H2SO4.
(CuOH)2SO4 + H2SO4.
II ступень: (CuOH)2SO4 + 2H2O  Cu(OH)2 + H2SO4.
Cu(OH)2 + H2SO4.
Очевидно, что при гидролизе по катиону cреда всегда кислая (рН < 7). Исходя из принципа Ле-Шателье можно сделать вывод о том, что гидролиз по второй ступени протекает значительно слабее, чем по первой, поэтому во многих случаях вторую (и последующие) ступени гидролиза не учитывают.
2. Гидролиз по аниону
Гидролиз по аниону является процессом обратимым, причем равновесие в большинстве случаев заметно сдвинуто влево. Рассмотрим гидролиз карбоната натрия, который при переходе в водный раствор диссоциирует по уравнению:
Na2CO3 = 2Na+ + CO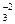 .
.
Далее идет гидролиз по 2 ступеням (в ионном виде):
I cтупень: CO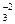 + H2O
+ H2O  HCO
HCO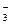 + OH-.
+ OH-.
II ступень: HCO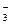 + H2O
+ H2O  H2CO3 + OH-.
H2CO3 + OH-.
В молекулярном виде:
I ступень: Na2CO3 + H2O  NaHCO3 + NaOH.
NaHCO3 + NaOH.
II ступень: NaHCO3 + H2O  H2CO3 + NaOH.
H2CO3 + NaOH.
При гидролизе по аниону среда щелочная (рН > 7). Все остальные рассуждения аналогичны тем, что были приведены при рассмотрении гидролиза по катиону.
3. Совместный гидролиз
В отличие от двух предыдущих случаев, совместный гидролиз является практически необратимой реакцией. Для протекания совместного гидролиза необходимо, чтобы в растворе одновременно находились гидролизующиеся катионы и гидролизующиеся анионы. Такая ситуация может возникнуть в 2 случаях:
a) если соль слабого основания и слабой кислоты растворить в воде (такое встречается нечасто, т.к. подавляющее большинство таких солей в воде растворимы очень плохо);
б) если смешать растворы двух солей, один из которых содержит гидролизующиеся катионы, а второй - гидролизующиеся анионы.
Соли слабых оснований и кислот, подвергающиеся полному гидролизу можно найти в таблице растворимости - они там обозначены прочерками. (Внимание! прочерк может соответствовать так же не существующему соединению).
Рассмотрим процессы, происходящие при растворении смешивании растворов AlCl3 и Na2CO3.
2Al+3 + 3CO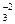 + 3H2O = 2Al(OH)3 ¯ + 3CO2
+ 3H2O = 2Al(OH)3 ¯ + 3CO2
2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3¯ + 3CO2 + 6NaCl.
ТЕМА 7. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Окислительно-восстановительными реакциями (ОВР) называются химические процессы, в ходе которых происходит передача электронов от одних частиц (атомов, молекул, ионов) к другим частицам (атомам, молекулам, ионам).
Окислителем называется частица, принимающая электроны от другой частицы.
Восстановителем называется частица, отдающая свои электроны другой частице.
Окисление - это процесс отдачи электронов.
Восстановление - это процесс присоединения электронов. Из этих определений следует, что в ходе ОВР окислитель восстанавливается, а восстановитель - окисляется.
В настоящее время наибольшее распространение получили 2 метода составления уравнений ОВР:
а) метод электронного баланса; б) метод полуреакций (или ионно-электронного баланса).
Метод полуреакций (электронно-ионного баланса)
Данный метод применяется для составления уравнений ОВР в водных растворах с участием электролитов.
В этом методе не используется понятие степень окисления, а рассматривается обмен электронами между реальными частицами, присутствующими в растворе - ионами и молекулами. Метод полуреакций позволяет использовать в качестве исходных неполные схемы реакций.
К недостаткам этого метода следует отнести его некоторую громоздкость и ограниченность в применении только растворами электролитов.
Алгоритм метода полуреакций (электронно - ионного баланса)
1. Написать схему реакции. Схема может быть полной или неполной. В случае использования неполной схемы из продуктов реакции необходимо знать только частицу, в которую перешел окислитель и частицу, в которую перешел восстановитель в ходе ОВР.
Пример:
а) полная схема реакции:
Na2Cr2O7 + K2SO3 + H2SO4 ® Cr2(SO4)3 + K2SO4 + Na2SO4 + H2O;
б) неполная схема этой же реакции, достаточная для применения метода полуреакций:
Na2Cr2O7 + K2SO3 + H2SO4 ® Cr+3 + SO +....
+....
Пока для простоты будем использовать полную схему взаимодействия. Применение метода полуреакций к неполным схемам рассмотрено в конце этой главы.
2. Написать ионную схему реакции. При этом, на ионы разбиваются только сильные электролиты, хорошо растворимые в воде (как при составлении обменных ионных уравнений):
2Na+ + Cr2O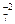 + 2K+ + SO
+ 2K+ + SO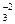 + 2H+ + SO
+ 2H+ + SO ®
®
2Cr+3 + SO + 2K+ + SO
+ 2K+ + SO + 2Na+ + SO
+ 2Na+ + SO + H2O.
+ H2O.
П р и м е ч а н и е. Стехиометрические коэффициенты перед ионами можно не указывать. Они не имеют никакого смысла, так как данное выражение является схемой, а не уравнением реакции:
Na+ + Cr2O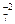 + K+ + SO
+ K+ + SO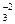 + H+ + SO
+ H+ + SO ®
®
Cr+3 + SO + K+ +SO
+ K+ +SO + Na+ + SO
+ Na+ + SO + H2O.
+ H2O.
3. Сравнить правую и левую части ионной схемы и найти частицы, изменившие свою химическую форму. Под изменением химической формы подразумевается:
а) изменение заряда частицы;
б) изменение формульного состава частицы.
П р и м е ч а н и е. В данном пункте частицы H+, OH- и H2O не рассматриваются.
SO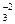 ® SO
® SO (произошло изменение формульного состава частицы);
(произошло изменение формульного состава частицы);
Сr2O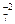 ® Cr+3 (произошло изменение как формульного состава, так и заряда частицы).
® Cr+3 (произошло изменение как формульного состава, так и заряда частицы).
4. Составить уравнения полуреакций окисления и восстановления. Это делается в такой последовательности.
а) уравниваются правые и левые части полуреакций по всем атомам, кроме кислорода и водорода:
SO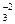 ® SO
® SO ,
,
Cr2O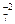 ® 2Cr+3,
® 2Cr+3,
б) полуреакции уравниваются по кислороду и водороду с учетом кислотности среды (далее будет рассмотрено отдельно)
SO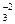 + H2O ® SO
+ H2O ® SO + 2H+,
+ 2H+,
Cr2O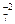 + 14 H+ ® 2Cr+3 + 7H2O,
+ 14 H+ ® 2Cr+3 + 7H2O,
в) полуреакции уравниваются по зарядам с помощью электронов. В первой полуреакции суммарный заряд частиц слева = -2, а справа = 0. Значит, справа нужно прибавить 2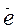 (или слева отнять 2
(или слева отнять 2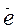 ):
):
SO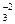 + H2O - 2
+ H2O - 2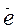 = SO
= SO + 2H+.
+ 2H+.
Для уравнивания второй полуреакции слева нужно прибавить 6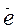 :
:
Cr2O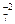 + 14H+ + 6
+ 14H+ + 6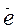 = 2Cr+3 + 7H2O.
= 2Cr+3 + 7H2O.
Полученные выражения являются уравнениями полуреакций.
5. Сделать электронный баланс, то есть подобрать коэффициенты, на которые необходимо умножить полуреакции окисления и восстановления, чтобы количество электронов, ушедших от восстановителя было равно числу электронов, пришедших к окислителю:

 SO
SO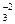 + H2O - 2
+ H2O - 2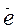 = SO
= SO + 2H+ 3
+ 2H+ 3
Cr2O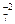 + 14H+ + 6
+ 14H+ + 6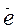 = 2Cr+3 + 7H2O 1
= 2Cr+3 + 7H2O 1
6. Умножить верхнее и нижнее уравнения полуреакций на коэффициенты электронного баланса. Затем сложить их и получить сокращенное ионное уравнение ОВР. В данном примере полуреакцию окисления нужно умножить на 3, а полуреакцию восстановления - на 1. После сложения получаем:
3SO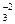 + 3H2O + Cr2O
+ 3H2O + Cr2O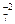 + 14H+ = 3SO
+ 14H+ = 3SO + 6H+ + 2Cr+3 + 7H2O.
+ 6H+ + 2Cr+3 + 7H2O.
Далее сокращаем (по Н2О и Н+):
3SO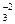 + Cr2O
+ Cr2O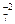 + 8H+ = 3SO
+ 8H+ = 3SO + 2Cr+3 + 4H2O.
+ 2Cr+3 + 4H2O.
Данное выражение является сокращенным ионным уравнением взаимодействия между восстановителем (SO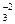 ) и окислителем (Cr2O
) и окислителем (Cr2O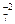 ) в кислой среде.
) в кислой среде.
Если необходимо получить молекулярное уравнение реакции, то следует выполнить еще один пункт.
7. Сокращенное ионное уравнение сложить с дополнительным ионным уравнением и получить полное ионное уравнение, которое затем преобразовать в молекулярное уравнение ОВР.
3SO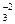 + Cr2O
+ Cr2O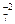 + 8H+ = 3SO
+ 8H+ = 3SO + 2Cr+3 + 4H2O,
+ 2Cr+3 + 4H2O,
6K+ + 2Na+ + 4SO = 6K+ + 3SO
= 6K+ + 3SO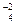 + 2Na+ + SO
+ 2Na+ + SO

6K+ + 3SO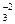 + 2Na+ + Cr2O
+ 2Na+ + Cr2O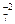 + 8H+ + 4SO
+ 8H+ + 4SO =
=
= 6K+ + 3SO + 2Cr+3 + 3SO
+ 2Cr+3 + 3SO + 4H2O + 2Na+ + SO
+ 4H2O + 2Na+ + SO .
.
3K2SO3 + Na2Cr2O7 + 4H2SO4 = Cr2(SO4)3 + 3K2SO4 + Na2SO4 + 4H2O.
П р и м е ч а н и е. В целях экономии времени полное ионное уравнение ОВР обычно не пишут, а при сложении сокращенного ионного с дополнительным ионным уравнением сразу же получают молекулярное уравнение.
Уравнивание полуреакций по кислороду и водороду с учетом
кислотности cреды
Как известно, в растворе среда может быть кислой, щелочной или нейтральной.
П р и м е ч а н и е. Если среда в растворе слабокислая (рН немного меньше 7) или слабо щелочная (рН немного больше 7) уравнивание производят, считая среду практически нейтральной.
I. Среда кислая (рН<< 7). Для составления полуреакции разрешены частицы только 2-х видов: это ион Н+ и молекула Н2О.
Полезно запомнить следующую схему:
2H+ + O* ~ H2O.
По элементному составу 2 иона Н+ и один атом “связанного” кислорода (О*) эквивалентны одной молекуле воды. Под “связанным” кислородом понимается атом кислорода, входящий в состав любой кислородсодержащей частицы (например: в молекуле СО2 два “связанных” кислорода, а в ионе SO - их четыре).
- их четыре).
II. Среда щелочная (рН >> 7). В данном случае для уравнивания по кислороду и водороду можно использовать только ионы ОН- и молекулы Н2О. Между этими частицами имеет место следующее соотношение (по элементарному составу):
2OH- ~ H2O + O*.
III. Среда нейтральная (рН» 7). Для уравнивания по кислороду и водороду в схеме полуреакции слева можно писать только Н2О. Справа могут появиться или Н+ или OH-.
ТЕМА 8. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
Электрохимическими процессами называются ОВР, осуществляемые в особых устройствах, позволяющих пространственно разделить стадии окисления и восстановления.
Полуреакции окисления и восстановления протекают на электродах, которые изготавливаются из материалов, хорошо проводящих электрический ток (различные металлы, графит). Электрод, на котором происходит окисление частиц называется анодом. Электрод, на котором происходит восстановление частиц называется катодом.
Если материал электрода принимает участие в окислительно-восстановительном взаимодействии, то такой электрод называется активным, если этого не происходит - инертным.
Электрохимические процессы подразделяются на: 1) самопроизвольные (идут в гальванических элементах и аккумуляторах); 2) несамопроизвольные (электролиз).
Если металл погрузить в водный раствор его соли, то металл относительно раствора приобретет некий потенциал - электродный потенциал. При этом в системе установится равновесие между гидратированными ионами металла Me+z в растворе и атомами металла в твердой фазе:
Me+z (aq) + ze-  Me(тв)
Me(тв)
В данной системе кусок металла является электродом (активным электродом, т.к. частицы, из которых он состоит могут обратимо переходить в раствор в виде ионов).
Величина электродного потенциала зависит от многих факторов. В специальных таблицах приведены значения стандартных электродных потенциалов (E°), измеренных при стандартных условиях (T = 298 K, p = 1,013.105 Па, концентрация ионов [Me+z] = 1 моль/л).
Если условия отличаются от стандартных, то электродный потенциал (E) электрода можно рассчитать по уравнению Нернста:
E = E° + 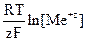 ,
,
где: E° - стандартный электродный потенциал, T - температура, R - универсальная газовая постоянная, F - постоянная Фарадея (96 485 Кл/моль), z - количество электронов, принимающих участие в элементарном окислительно-восстановительном акте на электроде.
Величина электродного потенциала определяет термодинамическую возможность и направление протекания ОВР на данном электроде в электрохимической системе.
|
|
|
|
Дата добавления: 2013-12-11; Просмотров: 401; Нарушение авторских прав?; Мы поможем в написании вашей работы!