
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамика. Данный раздел физики, как видно даже из названия, возник для описания работы тепловых машин
|
|
|
|
Данный раздел физики, как видно даже из названия, возник для описания работы тепловых машин. Затем по мере развития этой феноменологической науки, описание становилось все более общим, были определены универсальные понятия, например энтропия, сформулированы общие законы, которые теперь применяются в разных разделах естествознания.
В дальнейшем, при формулировании самых общих законов термодинамики, будем подразумевать под макросистемой некоторый объем газа, поскольку это наименее упорядоченная система с минимумом особенностей. С другой стороны нагретый газ, водяной пар – рабочее тело многих тепловых машин.
§ 1 Термодинамические параметры
До сих пор в физике мы занимались описанием движения микрочастиц в квантовой физике и материальных точек в классической механике. При этом мы определяли параметры каждой частицы такие, как положение в пространстве, импульс, энергию, момент импульса. Зная начальные условия, мы могли определить все параметры частицы в любой момент времени (конечно, с учетом соотношения неопределенности). Современные вычислительные средства позволяют решить задачу о поведении системы из нескольких частиц, для решения задачи о поведении нескольких десятков (тем более сотен) взаимодействующих частиц требуются уже все вычислительные ресурсы, доступные человеку.
Данный подход становится совершенно неприменим в макросистеме из-за большого числа частиц в ней. Однако взамен этого подхода, основанного на детальном описании каждой микрочастицы, появляется возможность определения некоторых средних величин, однозначно описывающих макросистему. В макросистеме, представляющей сплошную среду, мы уже определили ряд таких параметров (Механика, стр.94): плотность, давление. Эти, а также и ряд новых параметров, определенных ниже, используются в термодинамике.
Прежде чем говорить об отдельных термодинамических параметрах отметим, что их можно разделить на две группы – интенсивные, пропорциональные массе вещества и экстенсивные параметры, не зависящие от массы, например давление и температура.
Объем тела (газа, плазмы, жидкости, кристалла) 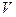 определяется тем, какую часть трехмерного пространства оно занимает. Объем твердого тела произвольной формы может быть измерен по объему вытесненной им жидкости.
определяется тем, какую часть трехмерного пространства оно занимает. Объем твердого тела произвольной формы может быть измерен по объему вытесненной им жидкости.
Количество вещества в системе 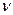 измеряется в молях. Это универсальный параметр, не зависящий от массы молекулы, а определяемый количеством молекул. В одном моле любого вещества содержится одинаковое число молекул (атомов), равное числу Авогадро
измеряется в молях. Это универсальный параметр, не зависящий от массы молекулы, а определяемый количеством молекул. В одном моле любого вещества содержится одинаковое число молекул (атомов), равное числу Авогадро 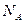 . В соответствии с современным определением
. В соответствии с современным определением 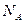 равно числу атомов углерода в 12 граммах изотопа
равно числу атомов углерода в 12 граммах изотопа 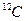 . Значение, рекомендованное CODATA, равно
. Значение, рекомендованное CODATA, равно  . Масса одного моля вещества
. Масса одного моля вещества  равна произведению числа Авогадро на массу одной молекулы (атома)
равна произведению числа Авогадро на массу одной молекулы (атома)  :
:  . Масса произвольного количества вещества равна произведению числа молей на молярную массу:
. Масса произвольного количества вещества равна произведению числа молей на молярную массу:  .
.
Плотность однородного тела  равна отношению его массы к объему тела. Если тело неоднородно, то плотность его в произвольной точке будет равна
равна отношению его массы к объему тела. Если тело неоднородно, то плотность его в произвольной точке будет равна  , где
, где  - малый объем, включающий точку с радиус-вектором
- малый объем, включающий точку с радиус-вектором  ,
, 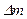 - масса всех частиц в этом объеме. В тоже время число микрочастиц в объеме
- масса всех частиц в этом объеме. В тоже время число микрочастиц в объеме  должно быть большим. Например, если мы хотим определить плотность с погрешностью не меньше
должно быть большим. Например, если мы хотим определить плотность с погрешностью не меньше 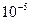 , то число частиц в объеме
, то число частиц в объеме  должно быть больше
должно быть больше 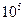 .
.
Поскольку объемы сосудов произвольной формы мы измеряем по объему помещающейся в них жидкости, эталон плотности жидкости играет важную роль в технике. Взвесив сосуд до и после заполнения его жидкостью, зная ее плотность, можем определить объем сосуда.
Государственный эталон плотности жидкости основан на гидростатическом взвешивании поплавка в воздухе и в жидкости. Его погрешность равна  .
.
Концентрация частиц (молекул, атомов, ионов, электронов и т.д.) в однородной среде определяется отношением  , где
, где  - число молекул в доступном для них объеме
- число молекул в доступном для них объеме  . Концентрация частиц связана с плотностью тела соотношением
. Концентрация частиц связана с плотностью тела соотношением 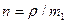 , где
, где  - масса одной частицы.
- масса одной частицы.
Давление 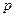 в сплошной среде (газ, жидкость) мы уже определили в Механике (стр.95-96).
в сплошной среде (газ, жидкость) мы уже определили в Механике (стр.95-96).
Температура  . Этот термодинамический параметр является мерой средней кинетической энергии молекул в макросистеме. Поскольку в естествознание этот параметр был введен задолго до появления молекулярно-кинетических представлений, его нельзя назвать интуитивно понятным. В переводе с латыни, temperatio – правильное соотношение, соразмерность. Если для двух макросистем обеспечить “тепловой контакт” – возможность обмениваться энергией без обмена частицами, то направление потока энергии от одной системы к другой (этот поток называют тепловым потоком) определяется температурами систем: он направлен от системы с большей температурой к системе с меньшей температурой. Со временем между этими двумя системами установится равновесие, их температура выровняется (температура-соразмерность объединенной системы установится).
. Этот термодинамический параметр является мерой средней кинетической энергии молекул в макросистеме. Поскольку в естествознание этот параметр был введен задолго до появления молекулярно-кинетических представлений, его нельзя назвать интуитивно понятным. В переводе с латыни, temperatio – правильное соотношение, соразмерность. Если для двух макросистем обеспечить “тепловой контакт” – возможность обмениваться энергией без обмена частицами, то направление потока энергии от одной системы к другой (этот поток называют тепловым потоком) определяется температурами систем: он направлен от системы с большей температурой к системе с меньшей температурой. Со временем между этими двумя системами установится равновесие, их температура выровняется (температура-соразмерность объединенной системы установится).
В аксиоматической термодинамике (не обосновываемой статистической физикой, а основанной на постулатах-аксиомах) в качестве нулевого начала термодинамики определяют принцип температуры: две системы, находящиеся в контакте обмениваются энергией до установления равновесия, характеризуемого равенством температур.
Будем обозначать энергию, переданную системе в результате теплообмена,  . Эта функция
. Эта функция  - функция процесса, в отличие от функций состояния. Изменения последних (пример – внутренняя энергия) при переходе системы из одного состояния в другое определяются только исходным и конечным состоянием и не зависят от пути перехода. Дифференциал функции состояния – всегда полный дифференциал, в отличие от функций процесса (пример – количество теплоты и работа). В связи с этим далее будем обозначать бесконечно малое количество теплоты либо
- функция процесса, в отличие от функций состояния. Изменения последних (пример – внутренняя энергия) при переходе системы из одного состояния в другое определяются только исходным и конечным состоянием и не зависят от пути перехода. Дифференциал функции состояния – всегда полный дифференциал, в отличие от функций процесса (пример – количество теплоты и работа). В связи с этим далее будем обозначать бесконечно малое количество теплоты либо 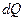 , либо
, либо 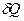 для того чтобы подчеркнуть, что эта величина не есть полный дифференциал.
для того чтобы подчеркнуть, что эта величина не есть полный дифференциал.
Определение температуры, основанное на направлении тепловых потоков между различными телами, позволяет определить только разность температур. Одна из первых температурных шкал, шкала Цельсия (A.Celsius, 1742), построена так, что разность температур 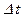 между кипящей водой при нормальном давлении и плавящимся льдом при нормальном давлении принимается равной ста градусам -
между кипящей водой при нормальном давлении и плавящимся льдом при нормальном давлении принимается равной ста градусам - 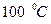 . Данная шкала используется в повседневной жизни до сих пор. За начало отсчета на ней принята температура, при которой находится в равновесии вода в твердой и жидкой фазах при нормальном давлении -
. Данная шкала используется в повседневной жизни до сих пор. За начало отсчета на ней принята температура, при которой находится в равновесии вода в твердой и жидкой фазах при нормальном давлении -  .
.
Средняя кинетическая энергия молекул может уменьшаться до минимального значения, определяемого квантово-механическим пределом. Если принять, что температура, соответствующая этой энергии, равна нулю, то возможно построение абсолютной шкалы температур. Однако в физике абсолютная шкала температур была предложена гораздо раньше Томсоном (W.Thomson, 1848) на основе анализа цикла Карно. Единица измерения температуры по этой шкале, называемой термодинамической, совпадает с градусом Цельсия и называется кельвином:  (в честь Томсона, которому было пожалован титул лорда Кельвина). В настоящее время кельвин определяется по единственной точке – тройной точке воды, которая соответствует температуре
(в честь Томсона, которому было пожалован титул лорда Кельвина). В настоящее время кельвин определяется по единственной точке – тройной точке воды, которая соответствует температуре  (точно по определению). Тройная точка – температура, при которой в равновесии в замкнутом объеме одновременно находятся три фазы – газообразная, жидкая и твердая. Начало отсчета на шкале Цельсия соответствует температуре
(точно по определению). Тройная точка – температура, при которой в равновесии в замкнутом объеме одновременно находятся три фазы – газообразная, жидкая и твердая. Начало отсчета на шкале Цельсия соответствует температуре  .
.
Термодинамическая шкала является основной шкалой в физике для определения температуры. Ее последнее уточнение сделано в 1990 г, поэтому она называется МШТ-90 (международная шкала температуры – international temperature scale – ITS-90).
Поскольку температура системы один из важнейших параметров остановимся на ее измерении несколько подробнее.
§2 Измерение температуры
Измерение температуры в международном стандарте МШТ-90 для различных диапазонов строится по-разному. Вся шкала построена на основе реперных (опорных) точек, которые приведены в таблице 2.1.
Таблица 2.1
| Основные реперные точки | ||
| вещество | реперная точка | температура |
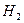
| тройная точка | 13.8033 |
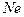
| тройная точка | 24.5561 |

| тройная точка | 54.3584 |

| тройная точка | 83.8058 |
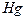
| тройная точка | 234.3156 |
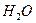
| тройная точка | 273.16 |

| температура плавления | 302.9146 |
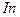
| температура кристаллизации | 429.7485 |
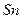
| температура кристаллизации | 505.078 |
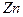
| температура кристаллизации | 692.677 |
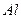
| температура кристаллизации | 933.473 |
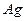
| температура кристаллизации | 1234.93 |

| температура кристаллизации | 1337.33 |
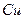
| температура кристаллизации | 1357.77 |
| Некоторые вторичные реперные точки | ||
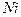
| температура кристаллизации | |
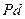
| температура кристаллизации | 1828.0 |
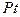
| температура кристаллизации | 2041.4 |
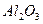
| температура плавления | |
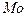
| температура плавления | |
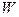
| температура плавления |
Для температур 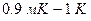 ее измеряют по зависимости температуры плавления
ее измеряют по зависимости температуры плавления 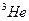 от давления. Эти измерения регламентируются временным дополнением к низкотемпературной шкале 2000 года (PLTS-2000). Температурная зависимость давления аппроксимируется степенной функцией
от давления. Эти измерения регламентируются временным дополнением к низкотемпературной шкале 2000 года (PLTS-2000). Температурная зависимость давления аппроксимируется степенной функцией
 (2.1)
(2.1)
с набором параметров 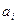 . Эти параметры и все другие, которые определяются далее, можно взять на сайте международной палаты мер и весов (Bureau International des Poids et Measures)*.
. Эти параметры и все другие, которые определяются далее, можно взять на сайте международной палаты мер и весов (Bureau International des Poids et Measures)*.
В диапазоне температур  она измеряется по зависимости давления насыщенного пара
она измеряется по зависимости давления насыщенного пара 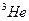 или
или  от температуры, которая аппроксимируется многопараметричной зависимостью:
от температуры, которая аппроксимируется многопараметричной зависимостью:
 . (2.2)
. (2.2)
Для диапазона температур  ее измерение проводят
ее измерение проводят  газовым термометром, аппроксимируя зависимость температуры от давления функцией
газовым термометром, аппроксимируя зависимость температуры от давления функцией
 . (2.3)
. (2.3)
Для калибровки газового термометра используют три точки: первая, при температуре до 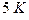 , она определяется так, как описано выше, вторая и третья точки – тройные точки водорода и неона.
, она определяется так, как описано выше, вторая и третья точки – тройные точки водорода и неона.
От тройной точки водорода до температуры кристаллизации серебра измерения температуры проводят с помощью платинового термометра сопротивления. В этом случае определяют параметр
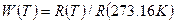 ,
,
равный отношению сопротивления платинового проводника при измеряемой температуре к его сопротивлению при температуре тройной точки воды. Поскольку удельное сопротивление металла зависит от концентрации примесей, дислокаций и других дефектов структуры, платина для терморезистора используется возможно более чистая, без внутренних напряжений. Окончательный отбор проволоки проводят по одному из критериев:
 или
или  .
.
Для произвольной температуры  определяем сопротивление
определяем сопротивление  , рассчитываем
, рассчитываем 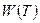 , а затем по одной из многопараметрических зависимостей
, а затем по одной из многопараметрических зависимостей  определяем температуру
определяем температуру  . Для диапазона температур от тройной точки водорода до тройной точки воды
. Для диапазона температур от тройной точки водорода до тройной точки воды  определяется так:
определяется так:
 , (2.5)
, (2.5)
от тройной точки воды до температуры кристаллизации серебра используется другая аппроксимация:
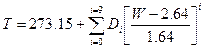 . (2.6)
. (2.6)
Выше температуры кристаллизации серебра ее измерение проводят с помощью оптического пирометра. Сравнивается спектральная плотность излучения АЧТ  (Квантовая физика 30.1) на определенной длине волны при измеряемой температуре и температуре кристаллизации серебра (можно использовать также температуры кристаллизации золота или меди):
(Квантовая физика 30.1) на определенной длине волны при измеряемой температуре и температуре кристаллизации серебра (можно использовать также температуры кристаллизации золота или меди):
 , (2.7)
, (2.7)
где 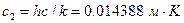 .
.
В России МШТ-90 с 1993 года поддерживается двумя государственными первичными эталонами. Первый работает в диапазоне температур  (ВНИИФТРИ), второй (ВНИИМ им. Д.И.Менделеева) работает в диапазоне температур
(ВНИИФТРИ), второй (ВНИИМ им. Д.И.Менделеева) работает в диапазоне температур  .
.
Дальнейшее уменьшение погрешности воспроизведения тройной точки воды столкнулось с трудностями стандартизации ее изотопного состава. Поэтому в ближайшем будущем предполагается определить  как производную от джоуля, причем связывать эти две единицы будет постоянная Больцмана.
как производную от джоуля, причем связывать эти две единицы будет постоянная Больцмана.
После общего описания шкалы температур перейдем к более подробному рассмотрению работы различных термометров и датчиков температуры.
Практически все свойства тела зависят от его температуры. Различные термометры строятся на зависимости какого-либо параметра тела от температуры.
Жидкостные термометры. Объем жидкости меняется с температурой. Эта зависимость положена в основу работы жидкостного термометра: 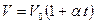 , здесь
, здесь 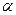 - коэффициент объемного расширения жидкости. Поскольку для жидкостей эта величина небольшая, например, у ртути он равен
- коэффициент объемного расширения жидкости. Поскольку для жидкостей эта величина небольшая, например, у ртути он равен  , для того чтобы заметить изменение объема глазом, жидкость помещают в объем с капилляром. Сделаем оценку радиуса этого капилляра для ртутного термометра, объем ртути в котором равен
, для того чтобы заметить изменение объема глазом, жидкость помещают в объем с капилляром. Сделаем оценку радиуса этого капилляра для ртутного термометра, объем ртути в котором равен  , а при изменении температуры на
, а при изменении температуры на  длина столбика ртути в капилляре меняется на
длина столбика ртути в капилляре меняется на 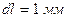 :
:
 ;
; 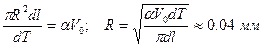 .
.
Чтобы увидеть такой узкий столбик жидкости стенки прозрачной трубки с капилляром делают толстыми, и они работают как линза. Главный недостаток жидкостных термометров – узкий температурный диапазон работы. К достоинствам можно отнести энергонезависимость подобных термометров.
Газовые термометры. Объем газа также меняется с температурой, если газ разряжен и подчиняется уравнению состояния идеального газа  , то он может использоваться в термометре, который называется идеальным газовым термометром. Давление газа пропорционально температуре. Зная объем газа, его количество, измерив давление, можем определить температуру. Подобный термометр можно использовать для калибровки в качестве эталона (для связи давления и температуры, конечно, нельзя при этом пользоваться уравнением состояния идеального газа, используют уравнение (2.3) с тремя параметрами). Для измерений на практике он мало пригоден, поскольку сам баллон является и датчиком температуры, а его объем должен быть большим по сравнению с объемом соединительных с датчиком давления трубок.
, то он может использоваться в термометре, который называется идеальным газовым термометром. Давление газа пропорционально температуре. Зная объем газа, его количество, измерив давление, можем определить температуру. Подобный термометр можно использовать для калибровки в качестве эталона (для связи давления и температуры, конечно, нельзя при этом пользоваться уравнением состояния идеального газа, используют уравнение (2.3) с тремя параметрами). Для измерений на практике он мало пригоден, поскольку сам баллон является и датчиком температуры, а его объем должен быть большим по сравнению с объемом соединительных с датчиком давления трубок.
Термометр сопротивления. Электрическое сопротивление металлического проводника зависит от температуры. На этой зависимости построен термометр сопротивления. О параметрическом задании  для платинового термометра сопротивления МШТ-90 мы уже говорили выше. Для менее точных измерений возможно использование более простых аппроксимаций с небольшим числом параметров.
для платинового термометра сопротивления МШТ-90 мы уже говорили выше. Для менее точных измерений возможно использование более простых аппроксимаций с небольшим числом параметров.
Кроме платиновых используют медные термометры сопротивления. Оценим необходимую длину медной проволоки диаметра 0.09 мм для изготовления термометра с сопротивлением при комнатной температуре ~ 100 Ом:
 .
.
Масса датчика температуры составит при этом ~3 г. Для уменьшения наводок в термометре сопротивления намотку делают бифилярной: сначала проволоку складывают вдвое, а затем наматывают на диэлектрический каркас. Подводящие проводники берут большего диаметра для уменьшения их влияния на общее сопротивление.
Термистор. Если в качестве материала термометра сопротивления взять полупроводник, то можно изготовить датчик температуры (его называют термистором) с температурным коэффициентом сопротивления существенно большим, чем у металлических термометров сопротивления. У термисторов температурный коэффициент сопротивления меньше нуля, поскольку их работа основана, в основном, на температурной зависимости концентрации носителей  . Она для собственных (нелегированных) полупроводников определяется экспоненциальной зависимостью
. Она для собственных (нелегированных) полупроводников определяется экспоненциальной зависимостью
 ,
,
где  - ширина запрещенной зоны полупроводника. Для легированных полупроводников концентрация свободных электронов
- ширина запрещенной зоны полупроводника. Для легированных полупроводников концентрация свободных электронов 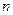 (или дырок
(или дырок 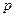 при легировании акцепторами) также экспоненциально зависит от температуры:
при легировании акцепторами) также экспоненциально зависит от температуры:
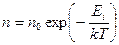 ,
,
где  - энергия ионизации доноров (акцепторов). Эти датчики температуры удобно использовать в различных регуляторах и стабилизаторах температуры в диапазоне 50 – 400 К.
- энергия ионизации доноров (акцепторов). Эти датчики температуры удобно использовать в различных регуляторах и стабилизаторах температуры в диапазоне 50 – 400 К.
Термопара. Если в проводнике обеспечить градиент температуры, например в проволоке вдоль нее, то на концах проволоки появится разность потенциалов. Действительно, в металлическом проводнике газ “свободных” электронов в грубом приближении подчиняется уравнению состояния 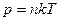 . “Давление” этого газа в пределах проводника (эквивалент сосуда для обычного газа) постоянно, поэтому в той части проводника, где температура выше, концентрация электронов будет меньше (рис.2.1а). Объемная плотность заряда уже не будет равна нулю. Решая уравнение Пуассона
. “Давление” этого газа в пределах проводника (эквивалент сосуда для обычного газа) постоянно, поэтому в той части проводника, где температура выше, концентрация электронов будет меньше (рис.2.1а). Объемная плотность заряда уже не будет равна нулю. Решая уравнение Пуассона  , можем найти разность потенциалов на концах проводника
, можем найти разность потенциалов на концах проводника 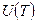 . Появление этой разности потенциалов называют объемным эффектом Зеебека (T.Seebeck, 1821).
. Появление этой разности потенциалов называют объемным эффектом Зеебека (T.Seebeck, 1821).
Кроме вклада в разность потенциалов, объясняемой на основе модели идеального газа, существует вклад, также обусловленный разностью концентраций электронов на концах, но объясняемый уже другим эффектом – увлечением свободных электронов потоком фононов (об этих квазичастицах мы уже говорили в Электродинамике, с.112). Направление потока фононов – от нагретого конца к холодному, поэтому вклад в разность потенциалов этого эффекта будет иметь такой же знак, что и для эффекта Зеебека.
Для практических измерений температуры  используют два разнородных металлических проводника -
используют два разнородных металлических проводника -  и
и  (рис.2.1b), концы которых сварены (добраться щупом вольтметра до конца проводника, который находится при температуре
(рис.2.1b), концы которых сварены (добраться щупом вольтметра до конца проводника, который находится при температуре  , затруднительно). Величина эффекта Зеебека в этих двух металлах различна, поэтому на концах термопары получаем разность потенциалов, называемую э.д.с. термопары, которая зависит от разности температур
, затруднительно). Величина эффекта Зеебека в этих двух металлах различна, поэтому на концах термопары получаем разность потенциалов, называемую э.д.с. термопары, которая зависит от разности температур 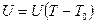 .
.
Рис.2.1
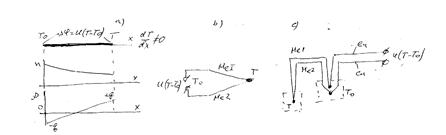
Чтобы исключить влияния изменения температуры окружающей среды холодные концы металлов  и
и  приваривают к медной проволоке и помещают в термостат с температурой
приваривают к медной проволоке и помещают в термостат с температурой  (рис.2.1с). В качестве датчика температуры термостата можно использовать термистор. Обычно температуру
(рис.2.1с). В качестве датчика температуры термостата можно использовать термистор. Обычно температуру  выбирают равной ~ 40 0С так, чтобы она была немного большей температуры окружающей среды, в которой работает оборудование.
выбирают равной ~ 40 0С так, чтобы она была немного большей температуры окружающей среды, в которой работает оборудование.
В термопаре, кроме эффекта Зеебека и увлечения фононами свободных носителей, появляется еще один вклад в ее э.д.с.: контактная разность потенциалов между металлами зависит от температуры. Эта зависимость обусловлена различным изменением с температурой энергии зон в металлах (нас, прежде всего, интересует изменение энергии валентной зоны). Этот вклад для некоторых пар металлов может превышать два выше упомянутых вклада.
Полупроводниковый диод может также использоваться, как датчик температуры. Если ток через диод, смещенный в прямом направлении, стабилизировать, то падение напряжения на нем будет зависеть от температуры, также как зависит от нее ширина запрещенной зоны. Данный эффект не очень мал, например, для арсенида галлия температурный коэффициент ширины запрещенной зоны равен:
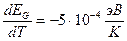 .
.
Подобный датчик температуры обладает хорошей линейностью и может быть использован в диапазоне температур 50 – 400 К.
Оптические пирометры. Работа монохроматического пирометра основана на использовании соотношения (2.7). Единственный его недостаток в том, что он калибруется по АЧТ, а реальные объекты – серые тела. Для измерения температуры произвольного нагретого тела используются бихроматические пирометры, в которых измеряется отношение сигналов фотоприемников на двух длинах волн 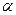 . Оно уже не зависит от отношения излучательной и поглощательной способности тела, а определяется только его температурой:
. Оно уже не зависит от отношения излучательной и поглощательной способности тела, а определяется только его температурой:
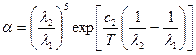 .
.
В простейших монохроматических пирометрах температура определяется при визуальном исчезновении нагреваемой нити на фоне объекта.
§ 3 Уравнение состояния
Термодинамические параметры макросистемы, находящейся в равновесии, зависят друг от друга. Уравнение, связывающее их, называют уравнением состояния системы:
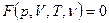 . (3.1)
. (3.1)
В термодинамике многие задачи мы будем решать в рамках моделей идеального газа, реального газа Ван-дер-Ваальса, используя параметрические уравнения и т.д.
Идеальный газ. В этой модели всяким взаимодействием молекул между собой в системе мы пренебрегаем. Молекулы могут взаимодействовать только со стенками сосуда. Связь между термодинамическими параметрами в этом случае задается уравнением Менделеева-Клапейрона:
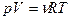 , (3.2)
, (3.2)
где 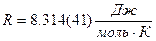 - универсальная газовая постоянная.
- универсальная газовая постоянная.
Газ Ван-дер-Ваальса. В этой модели учитывается конечный объем молекул газа с помощью параметра 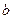 , а также слабое притяжение между молекулами, обусловленное дипольным взаимодействием на больших расстояниях между ними с помощью параметра
, а также слабое притяжение между молекулами, обусловленное дипольным взаимодействием на больших расстояниях между ними с помощью параметра 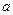 . Для одного моля газа уравнение состояния имеет вид:
. Для одного моля газа уравнение состояния имеет вид:
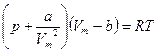 . (3.3)
. (3.3)
Оцените, при каком давлении использование уравнения состояния идеального газа будет давать отклонение большее одного процента при расчете  при постоянном объеме
при постоянном объеме
Параметрическое задание уравнения состояния. Если точность расчетов с использованием двух выше приведенных уравнений состояния неудовлетворительна, то используют уравнения состояния с большим числом параметров. Они могут иметь различную форму, в частности форму уравнений (2.1) – (2.3). Одна из часто используемых форм параметрического уравнения – уравнение с вириальными коэффициентами:
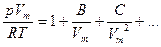 , (3.4)
, (3.4)
здесь  - второй вириальный коэффициент, определяемый парными взаимодействиями молекул,
- второй вириальный коэффициент, определяемый парными взаимодействиями молекул,  - третий вириальный коэффициент, определяемый тройными взаимодействиями и т.д.
- третий вириальный коэффициент, определяемый тройными взаимодействиями и т.д.
Для макросистем в жидкой или твердой фазах в качестве уравнения состояния можно использовать измеренную температурную зависимость коэффициента теплового расширения тела:
 , (3.5)
, (3.5)
Здесь  - объем тела при какой-либо температуре (обычно
- объем тела при какой-либо температуре (обычно  ). Другая форма уравнения состояния – температурная зависимость термического коэффициента давления:
). Другая форма уравнения состояния – температурная зависимость термического коэффициента давления:
 , (3.6)
, (3.6)
Здесь 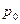 - давление при температуре
- давление при температуре  . И, наконец, в качестве уравнения состояния можно использовать температурную зависимость модуля всестороннего сжатия:
. И, наконец, в качестве уравнения состояния можно использовать температурную зависимость модуля всестороннего сжатия:
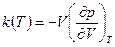 . (3.7)
. (3.7)
Все три величины, которые мы определили выше, можно связать между собой. Для этого выразим в уравнении (3.1) один из термодинамических параметров, например давление, через другие при неизменном количестве вещества, получим уравнение 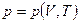 . Полный дифференциал этой функции равен
. Полный дифференциал этой функции равен
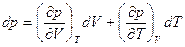 .
.
Для изобарического процесса 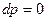 и связь между тремя термодинамическими параметрами может быть задана в самом общем виде соотношением
и связь между тремя термодинамическими параметрами может быть задана в самом общем виде соотношением
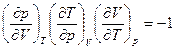 . (3.8)
. (3.8)
Используя его, можем найти связь между температурным коэффициентом объемного расширения, термическим коэффициентом давления и модулем всестороннего сжатия:
 . (3.9)
. (3.9)
§ 4 Квазиравновесные процессы
Поскольку в термодинамике мы имеем дело с равновесными состояниями, а всякий процесс предполагает наличие изменений, то определить равновесный процесс невозможно. В тоже время мы можем рассмотреть последовательность равновесных состояний. Например, если в термостате увеличить объем газа в цилиндре под поршнем на  , то спустя некоторое время в цилиндре установится новое равновесное состояние. Переходные процессы при установлении нового равновесного состояния будут продолжаться достаточно долго. Исходное и конечное состояния в координатах
, то спустя некоторое время в цилиндре установится новое равновесное состояние. Переходные процессы при установлении нового равновесного состояния будут продолжаться достаточно долго. Исходное и конечное состояния в координатах 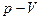 мы можем изобразить двумя точками (рис.4.1а,b). Изменяя объем далее можно изобразить точками последовательность равновесных состояний (рис.4.1с).
мы можем изобразить двумя точками (рис.4.1а,b). Изменяя объем далее можно изобразить точками последовательность равновесных состояний (рис.4.1с).
Рис.4.1
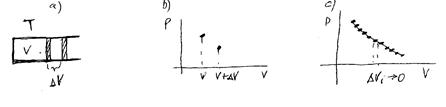
Если устремить  к нулю, то бесконечно большой набор равновесных состояний мы можем назвать равновесным процессом. Конечно, такой процесс на практике невозможен, поскольку он будет протекать бесконечно долго. Однако реальные процессы во многих случаях мы можем считать как бы равновесными (квазиравновесными). Правомерность и обоснованность подобного упрощения, естественно, проверяются на практике.
к нулю, то бесконечно большой набор равновесных состояний мы можем назвать равновесным процессом. Конечно, такой процесс на практике невозможен, поскольку он будет протекать бесконечно долго. Однако реальные процессы во многих случаях мы можем считать как бы равновесными (квазиравновесными). Правомерность и обоснованность подобного упрощения, естественно, проверяются на практике.
Из множества процессов выделим:
1) изотермический процесс, который протекает при постоянной температуре;
2) изохорический процесс, протекающий при постоянном объеме;
3) изобарический процесс, протекающий при постоянном давлении;
4) адиабатический процесс, который протекает в системе без теплообмена с внешней средой.
§ 5 Первый закон термодинамики
Рассмотрим особенности применения закона сохранения энергии для макросистемы. Будем считать, что она находится в непроницаемой оболочке. Если она жесткая, то энергия макросистемы может меняться только в результате теплообмена. Если же оболочка может деформироваться, то макросистема будет совершать работу при изменении объема. В последующих рассуждениях будем считать массу оболочки пренебрежимо малой по сравнению с массой исследуемой макросистемы.
Самой удобной для анализа является оболочка из жесткого цилиндра с подвижным поршнем площади 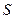 (рис.4.1а). Поршень находится в равновесии тогда, когда давление в изучаемой системе равно внешнему давлению
(рис.4.1а). Поршень находится в равновесии тогда, когда давление в изучаемой системе равно внешнему давлению 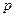 . При изменении объема на малую величину
. При изменении объема на малую величину  система совершит работу против внешнего давления, равную
система совершит работу против внешнего давления, равную
 . (5.1)
. (5.1)
Если это изменение объема проходило без теплообмена, то работа  может совершаться только за счет изменения внутренней энергии системы
может совершаться только за счет изменения внутренней энергии системы  :
:
 .
.
В термодинамике мы определяем внутреннюю энергию системы, измеряя работу в адиабатических условиях, с точностью до произвольной постоянной. С развитием молекулярно-кинетической теории понятие внутренней энергии было уточнено.
Энергия макросистемы в системе отсчета, связанной с ее центром масс, это ее внутренняя энергия  , равная кинетической энергии молекул и потенциальной энергии их взаимодействия. Кроме этого, во внутреннюю энергию макросистемы входит и “внутренняя” энергия молекул, поскольку она может меняться с изменением температуры. Для простейшей макросистемы – идеального одноатомного газа при невысоких температурах, когда атомы находятся в основном состоянии, внутренняя энергия будет равна произведению средней кинетической энергии атома на их число:
, равная кинетической энергии молекул и потенциальной энергии их взаимодействия. Кроме этого, во внутреннюю энергию макросистемы входит и “внутренняя” энергия молекул, поскольку она может меняться с изменением температуры. Для простейшей макросистемы – идеального одноатомного газа при невысоких температурах, когда атомы находятся в основном состоянии, внутренняя энергия будет равна произведению средней кинетической энергии атома на их число:
§ 6 Теплоемкость
Если телу сообщить некоторое количество теплоты 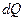 , то оно нагреется, его температура изменится на
, то оно нагреется, его температура изменится на 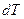 . Теплоемкостью тела
. Теплоемкостью тела  называют отношение
называют отношение
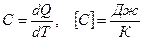 . (6.1)
. (6.1)
Более универсальными величинами являются:
удельная теплоемкость вещества
 (6.2)
(6.2)
- теплоемкость единицы массы однородного тела и
молярная теплоемкость вещества
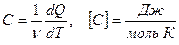 (6.3)
(6.3)
- теплоемкость одного моля вещества. Общепринято одинаково обозначать теплоемкость тела и молярную теплоемкость, поскольку с теплоемкостью тела мы сталкиваемся только при калориметрических измерениях, определяя теплоемкость калориметра.
В общем случае теплоемкость тела не является величиной постоянной, она меняется с изменением температуры. Поскольку три термодинамических параметра связаны уравнением состояния, для однозначного определения теплоемкости необходимо фиксировать один из параметров 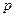 или
или 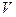 . Тогда для молярной теплоемкости мы можем определить теплоемкость при постоянном объеме
. Тогда для молярной теплоемкости мы можем определить теплоемкость при постоянном объеме
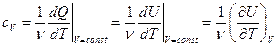 , (6.4)
, (6.4)
а также теплоемкость при постоянном давлении
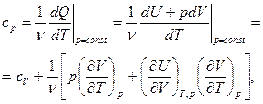 (6.5)
(6.5)
поскольку при постоянном давлении
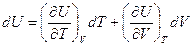 .
.
Для идеального газа из соотношения (6.4) получим внутреннюю энергию в виде
 , (6.6)
, (6.6)
поскольку она определяется только кинетической энергией молекул и не зависит от объема газа. В этом случае частная производная внутренней энергии по температуре будет полной производной и  . При стремлении кинетической энергии молекул к нулю температура и внутренняя энергия также стремятся к нулю.
. При стремлении кинетической энергии молекул к нулю температура и внутренняя энергия также стремятся к нулю.
Связь  и
и 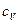 для идеального газа найдем, учитывая, что
для идеального газа найдем, учитывая, что
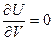 и
и 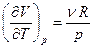 . Тогда получим, что
. Тогда получим, что
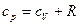 . (6.7)
. (6.7)
Среди множества процессов в термодинамике выделяют процессы, протекающие при постоянной теплоемкости  , которые называют политропическими процессами. Найдем уравнение политропы для идеального газа. В силу первого закона термодинамики для моля вещества
, которые называют политропическими процессами. Найдем уравнение политропы для идеального газа. В силу первого закона термодинамики для моля вещества
 .
.
Исключая давление 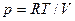 и разделяя переменные, придем к дифференциальному уравнению
и разделяя переменные, придем к дифференциальному уравнению
 .
.
Интегрируя его, получим, что
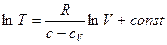 .
.
После потенцирования уравнение политропы в виде
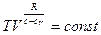
приведем к общепринятой форме после введения нового параметра – показателя политропы:
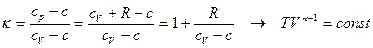 .
.
При использовании термодинамических параметров 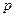 и
и 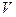 уравнение политропического процесса будет выглядеть следующим образом:
уравнение политропического процесса будет выглядеть следующим образом:
 . (6.8)
. (6.8)
Для различных процессов мы получим разные значения показателя политропы (рис.6.1).
Рис.6.1
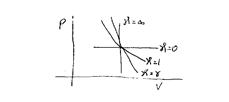
1. Адиабатический процесс. Для него  .
.
Уравнение адиабаты -  , где параметр
, где параметр  - показатель адиабаты.
- показатель адиабаты.
2. Изотермический процесс. Для него  .
.
3. Изохорический процесс. Для него  .
.
4. Изобарический процесс. Для него 
* www.bipm.org
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 682; Нарушение авторских прав?; Мы поможем в написании вашей работы!