
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Оксиды галогенов
|
|
|
|
Галогены образуют ряд соединений с кислородом. Но эти соединения неустойчивы, ∆Go >0, они легко взрываются при нагревании и в присутствии органических соединений. Их получают только косвенным путем.
Относительно устойчивы следующие кислородные соединения галогенов:
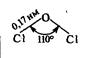
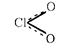
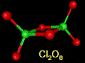
| Свойства | OF2 | Cl2O | ClO2 | Cl2O6 | Cl2O7 | I2O5 |
| Внешний вид при н.у. | Желтый газ | Желто-коричн. газ. Ядовит | Желто-зелен. газ. Ядовит | Темно-красная жидкость | Бесцветная жидкость. Взрывоопасна | Бесцв. крист. вещество |
| Темп. пл., оС | -223,8 | -116 | -59 | 3,5 | -90 (устойчивее остальных оксидов) | Разл. при t>350 oC |
| ∆Go, кДж/моль | +42,5 | 93,40 | 122,3 | - | ||
| Строение молекул | 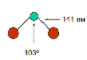
| 
| 
| 
| 
| 
|
| → Усиление окислительной активности → |
Также известны Cl2O3, Br2O3, BrO2, Br2O5, I2O4, I2O6.
Получение.
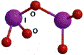
OF2 (оксид фтора, или правильнее – фторид кислорода) – сильнейший окислитель. Его получают действием F2 на охлажденный разбавленный раствор щелочи:
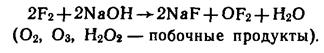
Оксиды хлора и йода можно получить по реакциям:
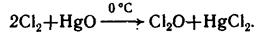

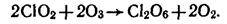
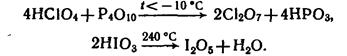
Химические свойства:
1. Термически неустойчивы:

2. Все соединения галогенов с кислородом (кроме OF2) – кислотные оксиды.
Cl2O, Cl2O7, I2O5 при взаимодействии с водой образуют кислоты:
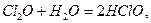
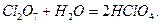
ClO2, Cl2O6 (С.О.=+4, +6 – неустойчивы) при взаимодействии с водой диспропорционируют:
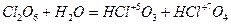 ,
,
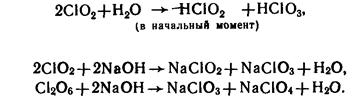
3. Оксиды галогенов – окислители:
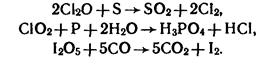
OF2 содержит O+2 – очень сильный окислитель:
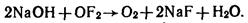
4. Оксиды с промежуточной степени окисления галогена диспропорционируют:
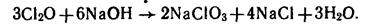
 .
.
- Кислородсодержащие кислоты галогенов
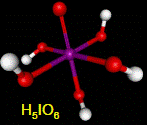
Все кислородсодержащие кислоты галогенов хорошо растворимы в воде. HClO4, HIO3 и H5IO6 известны в свободном виде, остальные нестойки, существуют только в разбавленный водных растворах. Наиболее стабильны соединения в С.О. -1 и +5.
| С.О. | Формула | Внешний вид | Кисл.-осн. свойства | К | Названия кислот | Названия солей |
| +1 | HOF HOCl HOBr HOI | Существуют только в растворе | Слабые кислоты Амфотерное соед. | 5∙10-8 2∙10-9 2∙10-10 | Фторноватистая Хлорноватистая Бромноватистая Иодноватистая | Гипофториты Гипохлориты Гипобромиты Гипоиодиты |
| +3 | HClO2 | -ʺ- | Кислота средн. силы | 1,1∙10-2 | Хлористая | Хлориты |
| +5 | HClO3 HBrO3 HIO3 | -ʺ- -ʺ- Бесцв. кристаллы | Сильные кислоты | 0,2 0,15 | Хлорноватая Бромноватая Иодноватая | Хлораты Броматы Иодаты |
| +7 | HClO4 (HBrO4) H5IO6 | Бесцв. жидкость Бесцв. кристаллы | Самая сильная кислота Слабая кислота | 1010 5∙10-4 | Хлорная Бромная Ортоодная | Перхлораты Перброматы Периодаты |
Сравнение силы кислот
Строение кислородных кислот хлора:
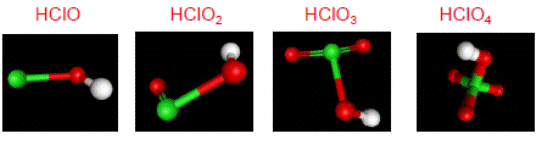
Изменение свойств в ряду кислородных кислот хлора можно показать схемой:

Эта закономерность характерна не только для хлора, но и для брома и иода.
При возрастании степени окисления галогена увеличивается заряд иона, это усиливает притяжение его к O2-, и затрудняет диссоциацию по типу основания. Вместе с этим увеличивается отталкивание положительный ионов H+ и Эn+, это облегчает диссоциацию по типу кислоты.

Рис. 1. Схема фрагмента молекулы Э(ОН)n
HOCl – амфотерное соединение: может диссоциировать и по типу кислоты, и по типу основания:
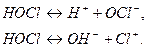
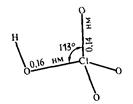
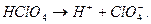
В ряду ClO- - ClO2- - ClO3- - ClO4- увеличивается устойчивость кислот и анионов. Это объясняется увеличением числа электронов, принимающих участие в образовании связей:
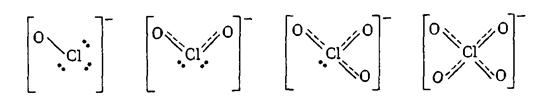
Кратность связи =1 Кратность связи=1,5
d(Cl-O)=0,170 нм d(Cl-O)=0,145 нм
С увеличением количества атомов кислорода в кислотах, увеличивается экранирование Cl, поэтому окислительная способность палает.
Таким образом, в ряду НClO → НClO2 → НClO3 → HClO4
- усиливается сила кислот;
- увеличивается устойчивость кислот;
- уменьшается окислительная способность.
Сила кислородсодержащих кислот в ряду HOCl-HOBr-HOI уменьшается из-за увеличения ковалентного радиуса и ослабления связи O-Hal:
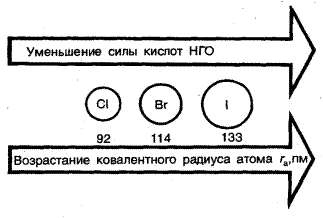
Кд 5∙10-8 2∙10-9 2∙10-10
 Окислительные свойства уменьшаются
Окислительные свойства уменьшаются
В ряду HCO-HBrO-HIO увеличивается устойчивость кислот. Например, при нагревании или действии света они разлагаются:
 , ∆Gо (кДж) HClO, HBrO, HIO
, ∆Gо (кДж) HClO, HBrO, HIO
-51,4 -5,2 54,5
Получение.
1. Фторноватистую кислоту получают при помощи реакций:
 . (при н.у.)!!!
. (при н.у.)!!!
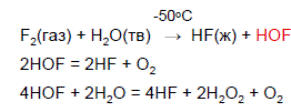
Хлорноватистую кислоту получают гидролизом хлора (НСl удаляют действием СaCO3):

Равновесие устанавливается, когда прореагирует 30% хлора.
HClO и HBrO получают разложением гипохлоритов и гипобромитов:
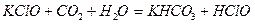 .
.
2. HClO2 получают из солей:
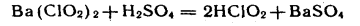 .
.
3. HHalO3 получают:
- из солей:
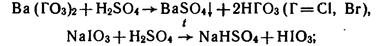
- окислением галогенов сильными окислителями:
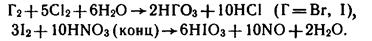
4. HClO4, H5IO6 из солей:
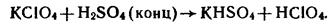
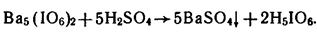
Химические свойства
- Разлагаются при нагревании и на свету:
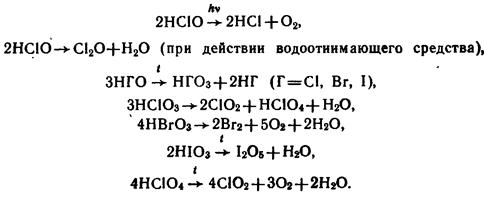
- Сильные окислители (все кислоты - более сильные окислители, чем их соли):
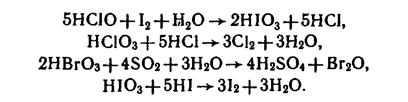
Хлорная кислоты – слабый окислитель только в концентрированных растворах:
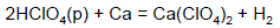
Соли оксокислот более устойчивы, чем кислоты. Их устойчивость растет с увеличением степени окисления.
Химические свойства солей:
1. Хлораты и перхлораты распадаются только при нагревании:
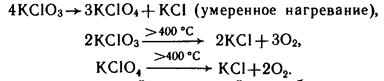

2. Они, как и кислоты, являются окислителями (но более слабыми, чем их кислоты):
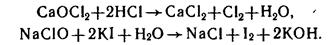
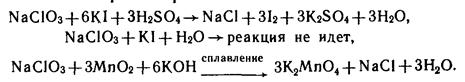
Получение солей:
МеHalO получают пропусканием галогегенов через холодный раствор щелочи, соды, поташа:
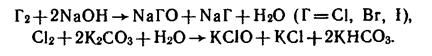
МеHalO3 получают пропусканием галогенов через горячие (60-70 оС) растворы щелочей:
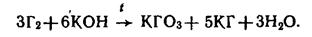
МеClO4 и Ме5IO6 окислением хлоратов и иодатов при электролизе или слабым нагреванием:

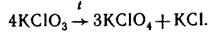
7. Применение
Фтор
Плавиковая кислота используется для травления стекла, удаления остатков песка с металлического литья, в химическом синтезе.
В ядерной промышленности применяют UF6.
В качестве хладагентов используют CF2Cl2.
В металлургии применяют CaF2.
Фторопроизводное этилена тетрафторэтилен в результате полимеризации дает ценный полимер – тефлон, устойчив к химическим реагентам и незаменим в производстве веществ особой чистоты, для изготовления аппаратуры.
Фторопроизводные материалы – в медицине, заменители кровеносных сосудов и сердечных клапанов. Изделия из фторопластов широко применяются в авиационной, электротехнической, атомной и др. отраслях.
Хлор
Хлор необходим для синтеза в органическом и полимерном синтезе. Методом хлорной металлургии получают кремний и тугоплавкие цветные металлы (титан, ниобий, тантал и др.).
Применяется как окислитель и для стерилизации питьевой воды.
Соляная кислота и галогениды используется в металлургической, текстильной и пищевой промышленности.
HClO применяется как бактерицидное и отбеливающее средство. Выделяющийся при растворении кислоты атомарный кислород обесцвечивает красители и убивает микробы:
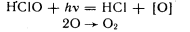 .
.
Жавелевая вода – это смесь хлорида и гипохлорита калия, ее получают действием щелочи на «хлорную воду», она обладает отбеливающими свойствами:
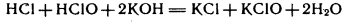 .
.
Белильная или хлорная известь – белый порошок с резким запахом, применяется как отбеливающее и дезинфицирующее средство:
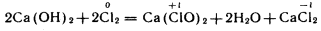 .
.
Бром
Используется в органическом синтезе.
В фотографическом деле используется AgBr.
Соединения брома применяются для производства лекарств.
Иод
I2 необходим для металлургии, его применяют как антисептическое и дезинфицирующее средство. Йод замещает атомы водорода в молекулах белков микроорганизмов, что приводит к их гибели:
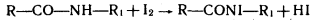 .
.
Для деревообработки применяют KI.
Cоединения иода применяются для производства лекарств, в пищевых добавках (NaI), для синтеза и в химическом анализа (иодометрия).
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 10240; Нарушение авторских прав?; Мы поможем в написании вашей работы!