
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типы химической связи
|
|
|
|
Метод валентных связей основывается на постулате, согласно которому все атомы стремятся обрести законченную электронную оболочку, но достигают этого разными способами. Атомы металлов обычно отдают электроны, приобретая при этом электронную конфигурацию атома предшествующего инертного газа. Атомы d - и f -элементов, проявляющие переменную валентность, могут иметь и другие устойчивые электронные конфигурации. Атомы неметаллов часто достраивают свой внешний электронный слой. Если в соединении присутствует более электроотрицательный элемент, неметалл может отдавать электроны до обретения устойчивой степени окисления (например, для Cl – это +1, +3, +5, +7).
Когда атом металла образует связь с атомом неметалла, первый отдает электроны, а второй принимает. В случае взаимодействия типичного металла с типичным неметаллом между их атомами образуется ионнаясвязь:
2Na + Cl2 = 2NaCl.
При реакции неметалла с неметаллом возникает ковалентнаясвязь. Для атомов одного вида такая связь будет неполярной:
О + О = О2.
Связь между атомами разных неметаллов является ковалентной полярной:
S + O2 = O=S=O.
Атомы металла в простом веществе достигают октета за счет образования валентными электронами единой системы (электронного газа), что называется металлическойсвязью и обусловливает высокую электро- и теплопроводность металла, а также его пластичность.
Для образования простой ковалентной связи каждый из атомов предоставляет по одному электрону:
А•|•Б.
При возникновении донорно-акцепторнойсвязи один атом – донор – предоставляет два электрона, а другой атом – акцептор – выделяет для этого вакантную электронную орбиталь:
А: | Б.
В случае дативнойсвязи оба атома либо обе частицы одновременно выступают в роли и донора, и акцептора электронов. Например,
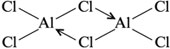
в димере Al2Cl6: «акцепторные» атомы хлора отдают свои неподеленные электронные пары, которыми заселяются вакантные d -орбитали «донорных» атомов алюминия.
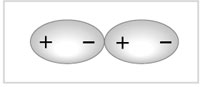
Межмолекулярныесвязи (взаимодействия) носят как электростатический, так и донорно-акцепторный характер (орбитальное связывание). Среди межмолекулярных взаимодействий можно выделить диполь-дипольное. Очевидно, что два диполя будут ориентироваться относительно друг друга противоположными полюсами (рис. 3.1).
|
| Рис. 3.1. Схема диполь-дипольного взаимодействия |
Наиболее ярким примером диполь-дипольного взаимодействия является водородная связь:
Н2О…Н–О–Н.
Другой тип межмолекулярного взаимодействия – индукционное. Любой диполь, безусловно, оказывает электростатическое воздействие на рядом находящиеся неполярные молекулы, вызывая их поляризацию (рис. 3.2).

|
| Рис. 3.2. Схема индукционного взаимодействия |
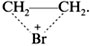
Например, неполярная молекула брома, подходя к  -облаку молекулы этилена, поляризуется так, что атакующим центром оказывается атом брома с частично положительным зарядом на нем. Об этом свидетельствует образование промежуточного бромониевого катиона:
-облаку молекулы этилена, поляризуется так, что атакующим центром оказывается атом брома с частично положительным зарядом на нем. Об этом свидетельствует образование промежуточного бромониевого катиона:
Возможно межмолекулярное взаимодействие и между совершенно неполярными молекулами. Мы привыкли рассматривать электронную плотность как нечто неизменное во времени. Однако электронная плотность, как и атмосфера Земли, подвержена колебаниям (флуктуациям). Смещение электронной плотности у одного атома (образование мгновенного диполя) вызовет соответствующее смещение и у другого (рис. 3.3).

|
| Рис. 3.3. Схема дисперсионного взаимодействия |
Следствием подобных сдвигов электронной плотности является взаимное притяжение атомов. Данное взаимодействие называется дисперсионным и позволяет объяснить возможность существования конденсированных фаз (жидкой и твердой) для совершенно неполярных атомов и молекул, например для гелия.
Все вышесказанное, касающееся типов химической связи, наглядно можно представить в виде следующей схемы (рис. 3.4).

|
| Рис. 3.4. Схема классификации химических связей |
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 457; Нарушение авторских прав?; Мы поможем в написании вашей работы!