
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ферменты, витамины
|
|
|
|
Белки
Аминокислоты
Белки их строение, функции и значение.
В клетках и тканях встречается свыше 170 различных аминокислот. В составе белков обнаруживаются лишь 26 из них; обычными же компонентами белка можно считать лишь 20 аминокислот.
Растения синтезируют все необходимые им аминокислоты из более простых веществ. В отличие от них животные не могут синтезировать все аминокислоты, в которых они нуждаются; часть из них они должны получать в готовом виде, т. е. с пищей. Эти последние принято называть незаменимыми аминокислотами. Следует, однако, подчеркнуть: название «незаменимые» вовсе не означает, что эти аминокислоты в качестве компонентов животных белков в чем-то важнее остальных. «Незаменимы» они лишь в том смысле, что организм животного не способен их синтезировать.
Часть аминокислот синтезируются в самом организме человека, но существует, как известно, 10 незаменимых аминокислот (валин, лейцин, изолейцин, треонин, метионин, фенилаланин, триптофан, лизин, гистидин и аргинин), синтез которых в организме невозможен. Незаменимые аминокислоты поступают в организм в составе белков пищи. Отсутствие или недостаток незаменимых аминокислот приводит к остановке роста, падению массы, нарушениям обмена веществ, при острой недостаточности — к гибели организма.
Белки, в которых содержится достаточное количество таких аминокислот, называют полноценными. Лишь белки немногих растений (семена бобовых) приближаются по аминокислотному составу к животным белкам.
Белки - это сложные органические соединения, состоящие из углерода, водорода, кислорода и азота.
В некоторых белках содержится еще и сера. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь. Молекулы белков - цепи, построенные из аминокислот, - очень велики; это макромолекулы, молекулярная масса которых колеблется от нескольких тысяч до нескольких миллионов. В природных белках встречаются двадцать различных аминокислот. Потенциально разнообразие белков безгранично, поскольку каждому белку свойственна своя особая аминокислотная последовательность, генетически контролируемая, т.е. закодированная в ДНК клетки, вырабатывающей данный белок. Белков в клетках больше, чем каких бы то ни было других органических соединений: на их долю приходится свыше 50% общей сухой массы клеток. Они - важный компонент пищи животных и могут превращаться в животном организме как в жир, так и в углеводы. Большое разнообразие белков позволяет им выполнять в живом организме множество различных функций, как структурных, так и метаболических.
Классификация белков
Сложность строения белковых молекул и чрезвычайное разнообразие их функций крайне затрудняют создание единой четкой классификации белков на какой-либо одной основе. В табл. приведены три разные классификации белков, основанные на различных их характеристиках.



Структура белков
Каждому белку свойственна своя особая геометрическая форма, или конформация. При описании трехмерной структуры белков рассматривают обычно четыре разных уровня организации.
Первичная структура
Под первичной структурой белка понимают число и последовательность аминокислот, соединенных друг с другом пептидными связями в полипептидной цепи. Первые исследования по выяснению аминокислотной последовательности белков были выполнены в Кембриджском университете Ф. Сэнгером, дважды удостоенным за свои работы Нобелевской премии. Сэнгер работал с гормоном инсулином, и это был первый белок, для которого удалось выяснить аминокислотную последовательность. Работа заняла ровно 10 лет (1944-1954 гг.). В молекулу инсулина входит 51 аминокислота, а молекулярная масса этого белка равна 5733. Молекула состоит из двух полипептидных цепей, удерживаемых вместе дисульфидными мостиками.
Рис. 5.33. Первичная структура лизоцима. Лизоцим-это фермент, обнаруженный во многих тканях и секретах человеческого тела, в растениях и яичном белке. Этот фермент катализирует разрушение клеточных стенок бактерий. Молекула лизоцима состоит из одной пол и пептидной цепи, в которую входит 129 аминокислотных остатков. В молекуле имеется четыре внутри цепочечных дисульфидных мостика.
В настоящее время большая часть работ по определению аминокислотных последовательностей автоматизирована, и теперь первичная структура известна уже для нескольких сотен белков. В организме человека свыше 10 000 различных белков, и все они построены из одних и тех же 20 стандартных аминокислот. Аминокислотная последовательность белка определяет его биологическую функцию. В свою очередь эта аминокислотная последовательность однозначно определяется нуклеотидной последовательностью ДНК. Замена одной - единственной аминокислоты в молекулах данного белка может резко изменить его функцию, как это наблюдается, например, при так называемой серповидноклеточной анемии.
Интересные данные могут быть получены в результате анализа аминокислотных последовательностей гомологичных белков, принадлежащих разным биологическим видам; такие данные позволяют судить о возможном таксономическом родстве между этими видами.
Вторичная структура
Для всякого белка характерна помимо первичной еще и определенная вторичная структура. Обычно белковая молекула напоминает растянутую пружину. Это так называемая а-спираль, стабилизируемая множеством водородных связей, возникающих между находящимися поблизости друг от друга СО- и NH-группами. Атом водорода NH-группы одной аминокислоты образует такую связь с атомом кислорода СО-группы другой аминокислоты, отстоящей от первой на четыре аминокислотных остатка (считая вдоль цепи назад) (рис. 5.34 Рис. 5.34. Структура a-спирали. А. Показаны a-атомы углерода. Соединяющая их линия описывает а-спираль. Б. Модель а-спирал и из стержней и шариков. В. Часть а-спирал и в растянутом виде. Спираль стабилизируется водородными связями.). Рентгеноструктурный анализ показывает, что на один виток спирали приходится 3,6 аминокислотного остатка.
Третичная структура
У большинства белков полипептидные цепи свернуты особым образом в компактную глобулу. Способ свертывания полипептидных цепей глобулярных белков называется третичной структурой. Третичная структура поддерживается уже обсуждавшимися выше связями трех типов - ионными, водородными и дисульфидными,а также гидрофобными взаимодействиями. В количественном отношении наиболее важны именно гидрофобные взаимодействия; белок при этом свертывается таким образом, чтобы его гидрофобные боковые цепи были скрыты внутри молекулы, т.е. защищены от соприкосновения с водой, а гидрофильные боковые цепи, наоборот, выставлены наружу.
Четвертичная структура.
Многие белки с особо сложным строением состоят из нескольких полипептидных цепей, удерживаемых в молекуле вместе за счет гидрофобных взаимодействий, а также при помощи водородных и ионных связей. Способ совместной упаковки и укладки этих полипептидных цепей называют четвертичной структурой белка. Четвертичная структура имеется, например, у гемоглобина. Его молекула состоит из четырех отдельных полипептидных цепей двух разных типов: из двух а-цепей и двух р-цепей. Две а-цепи содержат по 141 аминокислотному остатку, а две Р-цепи-по 146 остатков. Полную структуру гемоглобина определили Кендрью и Перуц (Kend-rew, Perutz).
Некоторые вирусы, например вирус мозаики табака, имеют белковую оболочку, состоящую из многих полипептидных цепей, упакованных высокоупорядоченным образом.
Рис. 5.39. Структура гемоглобина. Молекула состоит из четырех полипептидных цепей: двух a-цепей и двух fi-цепей. С каждой цепью связанаодна группа тема, к которой присоединяется молекула кислорода. Гемоглобин - пример белка, состоящего из отдельных субьединиц, т. е. обладающего четвертичной структурой.
Ферменты - это белковые молекулы, синтезируемые живыми клетками. В каждой клетке имеются сотни различных ферментов. С их помощью осуществляются многочисленные химические реакции, которые могут с большой скоростью идти при температурах, подходящих для данного организма, т. е. в пределах от 5 до 40 °С. Чтобы эти реакции с той же скоростью протекали вне организма, потребовались бы высокие температуры и резкие изменения некоторых других условий. Для клетки это означало бы гибель, ибо вся работа клетки строится таким образом, чтобы избежать любых сколько-нибудь заметных изменений в нормальных условиях ее существования.
Ферменты, следовательно, можно определить как биологические катализаторы, т.е. как вещества, ускоряющие реакции. Они абсолютно необходимы, потому что без них реакции в клетке протекали бы слишком медленно и не могли поддерживать жизнь.
Ферментативные реакции подразделяются на анаболические (реакции синтеза) и катаболические (реакции распада). Совокупность всех этих реакций в живой клетке или в живом организме составляет то, что мы называем метаболизмом. Метаболизм, таким образом, слагается из анаболизма и катаболизма.
Обычно для того чтобы превратить данное исходное вещество через ряд промежуточных соединений в продукт (или продукты), несколько ферментов действуют последовательно один за другим. Такая последовательность реакций составляет так называемый метаболический путь.
В клетке работает одновременно много метаболических путей. Реакции протекают согласованно, подчиняясь строгой регуляции, что объясняется специфической природой ферментов. Один фермент обычно катализирует только одну реакцию. Таким образом, ферменты служат для регулирования происходящих в клетке реакций и обеспечивают надлежащую их скорость.
Биологические катализаторы (т. е. ферменты) характеризуются следующими основными свойствами:
1. все ферменты представляют собой глобулярные белки;
2. они увеличивают скорость реакции, но сами в этой реакции не расходуются; их присутствие не влияет ни на природу, ни на свойства конечного продукта (или продуктов) реакции;
3. очень малое количество фермента вызывает превращение больших количеств субстрата;
4. активность ферментов меняется в зависимости от рН, температуры, давления и от концентраций как субстрата, так и самого фермента;
5. катализируемая реакция обратима;
6. ферменты обладают специфичностью, т. е. один фермент катализирует обычно только одну реакцию.
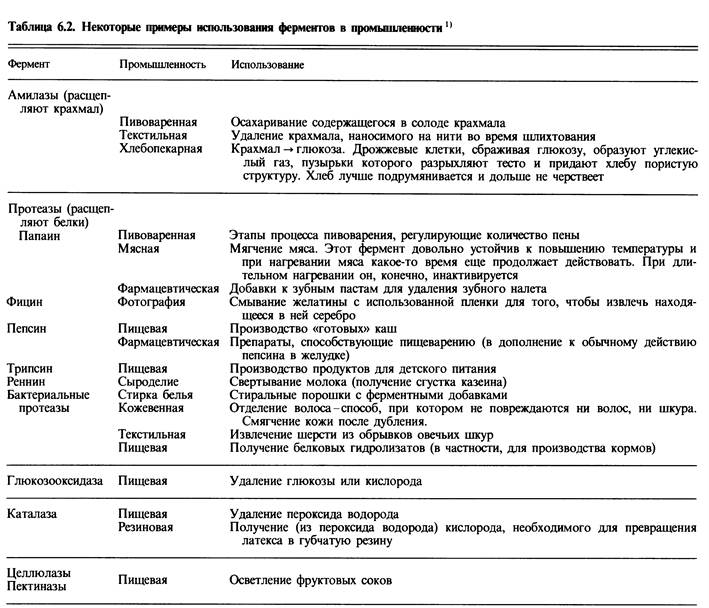

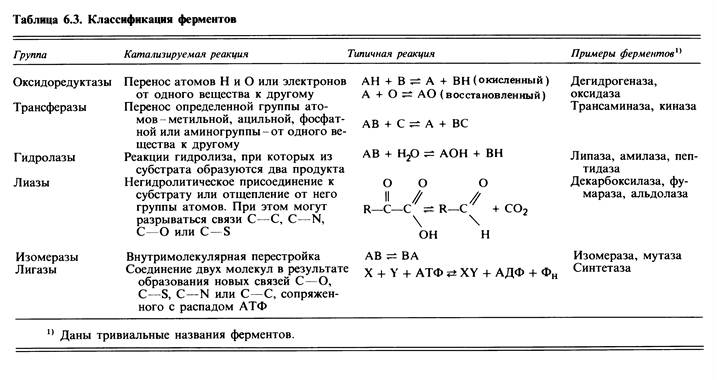
В 1961 г. специальной комиссией Международного биохимического союза была предложена систематическая номенклатура ферментов. Ферменты были подразделены на шесть групп в соответствии с общим типом реакции, которую они катализируют. Каждый фермент получил систематическое наименование, точно описывающее катализируемую им реакцию. Однако, поскольку многие из этих систематических названий оказались очень длинными и сложными, каждому ферменту было присвоено также и «тривиальное», рабочее название, предназначенное для повседневного употребления. Рабочее название состоит из названия субстрата, на который действует данный фермент, указания на тип катализируемой реакции и окончания «-аза». (Пример: рибулозобисфосфаткарбоксилаза; здесь субстрат - рибулозобисфосфат (+ С02), а тип реакции - карбо-ксилирование (добавление С02).
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 1483; Нарушение авторских прав?; Мы поможем в написании вашей работы!