
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Металлическая связь
|
|
|
|
Рис. 19. Переход электрона от атома Nа к атому Cl
При этом атом натрия теряет один отрицательный заряд и становится катионом N3+, а атом хлора приобретает этот заряд и становится анионом С1-.
СЛ. 26(1) Оценка зарядов на атомах натрия и хлора в состоянии ионов следует из сравнения числа протонов в их ядрах и общего числа электронов на их оболочках.
Nа —> Nа+ С1 — > Сl-
Ядро 11р+ 11р+ 17р+ 17р+
Оболочка 11е- 10е- 17е- 18е-
В рамках орбитальной модели атома образование ионов Na+ и С1- объясняется так СЛ 27:
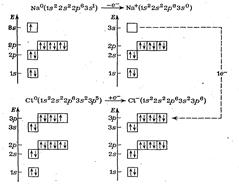
Переход 3s-электрона атома натрия на 3p-подуровень хлора показан пунктирной стрелкой справа. Третий энергетический уровень имеет еще пять 3d-АО, но так как 3d-подуровень начинает заполняться только у атомов элементов четвертого периода, он здесь не показан ион С1- находится в промежуточном устойчивом состоянии благородного газа.
Для простоты вместо эффективных зарядов обычно указывают целочисленные заряды ионов (Nа+)(С1-), имея в виду, что именно такие ионы образуются при электролитической диссоциации ионного соединения NаС1 в водном растворе или в расплаве: NаС1 = Nа+ + С1-.
Для того, чтобы решить, является ли данная связь преимущественно ковалентной или преимущественно ионной (и соответствующим способом интерпретировать свойства соединений), можно прибегнуть к оценке по методу Полинга. Химическая связь с 50 %-ой ионностью отвечает разности Dc = 1,7; при Dc > 1,7 связь будет по преимуществу ионная, например, как для NаС1 (Dc = 2,1), например СЛ. 28:
| CsCl | BaCl2 | MgCl2 | AlCl3 | SnCl2 | BiCl3 | |
| Dc | 2,3 | 2,1 | 1,8 | 1,5 | 1,2 | 1,1 |
Очевидно, что СsС1, ВаС12 и МgС12 — ионные соединения, остальные хлориды (А1С13, SпСl2 и ВiС1з) — ковалентные.
Чтобы изобразить образование ионов в химической реакции между нейтральными атомами, уравнение химической реакции записывают с помощью электронных формул СЛ 29(0):
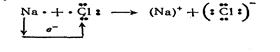
При этом следует использовать правило равенства чисел электронов, переданных в реакции: число отданных электронов должно быть равно числу принятых электронов.
В соответствии с этим правилом подбираются стехиометрические коэффициенты в уравнении реакции СЛ 29(1):
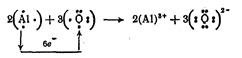
Металлы и сплавы металлов кристаллизуются в форме металлических решеток. Узлы в металлической решетке заняты положительными ионами металлов (атомными остовами металлов). Все металлы, за редкими исключениями, кристаллизуются в одном из трех типов решеток. При кубической плотневшей упаковке атомных остовов формируется гранецентрированная решетка, при гексагональной плотневшей упаковке — гексагональная решетка. Кристаллы щелочных металлов, бария и некоторых переходных металлов образуют объемно центрированную кубическую решетку. Названия решеток соответствуют упаковке атомных остовов в вершинах и серединах граней элементарного куба, в виде гексагональной призмы и в вершинах и геометрическом центре элементарного куба.
Заполнение гранецентрированной кубической и гексагональной решеток атомными остовами является максимально возможным при данных геометрических размерах атомных остовов металлов поэтому такие виды упаковок атомов называются плотневшими. Плотневшим упаковкам атомов соответствует и максимальное координационное число решетки, т. е. число ближайших соседей, окружающих данный атомный остов в пространстве. Для кубической и гексагональной плотневших упаковок координационное число равно 12 в объемно центрированной кубической решетке координационное число равно 8.
Валентные электроны, отделившиеся от атомов металлов и оставившиеся в узлах решетки соответствующие атомные остовы (катионы), более или менее свободно перемещаются в пространстве между катионами и обусловливают металлическую электрическую проводимость металлов. По аналогии с молекулами газообразного вещества, совершающими хаотическое движение, подвижные электроны рассматривают как электронный газ в металле.
Устойчивость металлической решетки обеспечивается наличием электростатического притяжения между положительно заряженными атомными остовами и отрицательно заряженными подвижными электронами. Связывающие кулоновские силы действуют на все соседние атомные остовы равномерно и поэтому они менее прочные, чем силы направленного химического связывания в атомных кристаллических решетках. Вследствие этого большинство металлических простых веществ, в отличие от алмазоподобных веществ, имеют относительно низкие температуры плавления, например:
Сs Nа Sn РЬ А1 Ва Аg Сu Fе
т. пл., °С 29 98 232 328 660 727 962 985 1539
(Важнейшие исключения: Мо 2620, Rе 3190, W 3387 °С).
Подобно атомам в атомных решетках и ионам в ионных решетках, катионы в металлических решетках, не обладающие поступательным движением, постоянно совершают колебания вокруг положения узлов решетки. Амплитуда этих колебаний при нагревании возрастает, и при достижении температуры плавления металла решетка разрушается. Температура плавления металлов, как правило, возрастает с увеличением числа валентных электронов в их атомах и с уменьшением расстояния между атомными остовами в решетке — параметра решетки а.
кальций плавится при значительно более высокой температуре, чем калий, в основном по причине удвоенного числа валентных электронов (параметры их решетки почти одинаковы).
От упаковки кристаллических решеток зависит пластическая деформируемость (ковкость) металлов. Она тем выше, чем больше в металлической решетке плотневших шаровых слоев (плоскостей трансляции, т. е. плоскостей параллельного переноса слоев) и чем меньше пустот, тормозящих скольжение слоев. Наименьшая ковкость у металлов с гексагональной решеткой, промежуточная — с объемно центрированной кубической решеткой и наибольшая — с гранецентрированной кубической решеткой.
П р и м е р. При нагревании железа до 911°С низкотемпературная объемно центрированная кубическая решетка (так называемое a-железо) переходит в гранецентрированную кубическую решетку (так называемое g-железо); по этой причине раскаленное железо значительно легче поддается ковке.
При затвердевании металлических расплавов происходит массовая кристаллизация и возникает одновременно множество мелких кристалликов, они называются кристаллитами. Рост кристаллита протекает в окружении подобных мелких кристаллов, при этом исключается значительное увеличение размеров кристаллитов и поэтому они не видны визуально на изломе металла и образец металла кажется монолитным.
Смеси двух или более индивидуальных металлов называются сплавами. В сплавах могут присутствовать в небольших количествах и некоторые неметаллы. Распространенным методом получения сплавов является совместное нагревание их составных частей до полного расплавления смеси. Однако есть металлы, которые не сплавляются друг с другом в любых отношениях.
Металлические сплавы можно классифицировать так: твердые растворы внедрения; твердые растворы замещения; смеси индивидуальных кристаллов металлов; смеси кристаллов интерметаллических соединений.
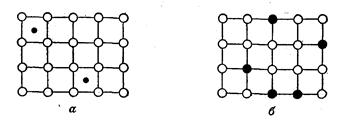
В сплавах, представляющих собой твердые растворы внедрения рис. 20а СЛ. 30, часть межузельных полостей металлической кристаллической решетки занята атомами другого элемента (например, углерода). Такие примеси часто упрочняют сплав, например, чугун, сталь — железо, содержащее примесные атомы углерода, значительно тверже, чем чистое железо.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 334; Нарушение авторских прав?; Мы поможем в написании вашей работы!