
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обменный механизм образования ковалентной связи по методу ВС. Направленность и насыщаемость ковалентной связи
|
|
|
|
Квантово-механическая модель ковалентной связи по методу валентных связей на примере молекулы водорода
Ван-дер-ваальсовая
Водородная
Металлическая
Ионная
Ковалентная
Типы химической связи
Энергия химической связи
Согласно принципу наименьшей энергии, внутренняя энергия молекулы по сравнению с суммой внутренних энергий образующих ее атомов должна понижаться. Внутренняя энергия молекулы включает сумму энергий взаимодействия каждого электрона с каждым ядром, каждого электрона с каждым другим электроном, каждого ядра с каждым другим ядром. Притяжение должно превалировать над отталкиванием.
Важнейшей характеристикой связи является энергия, определяющая ее прочность. Мерой прочности связи может служить как количество энергии, затрачиваемой на ее разрыв (энергия диссоциации связи), так и величина, которая при суммировании по всем связям дает энергию образования молекулы из элементарных атомов. Энергия разрыва связи всегда положительна. Энергия образования связи по величине та же, но имеет отрицательный знак.
Для двухатомной молекулы энергия связи численно равна энергии диссоциации молекулы на атомы и энергии образования молекулы из атомов. Например, энергия связи в молекуле НВr равна количеству энергии, выделяющейся в процессе Н + Вr = НВr.
В 1927 г. уравнение Шрёдингера было решено для молекулы водорода немецкими физиками В.Гейтлером и Ф.Лондоном. Это была первая удачная попытка применения квантовой механики к решению проблем связи. Их работа заложила основы метода валентных связей, или валентных схем (ВС).
Результаты расчета можно представить графически в виде зависимостей сил взаимодействия между атомами (рис. 1, а) и энергии системы (рис. 1, б) от расстояния между ядрами атомов водорода. Ядро одного из атомов водорода поместим в начало координат, а ядро второго будем приближать к ядру первого атома водорода вдоль оси абсцисс. Если спины электронов антипараллельны, силы притяжения (см. рис. 1, а, кривая I) и силы отталкивания (кривая II) будут нарастать. Результирующая этих сил представлена кривой III. Сначала преобладают силы притяжения, затем – отталкивания. Когда расстояние между ядрами становится равным r0 =0,74 Å, сила притяжения уравновешивается силой отталкивания. Равновесию сил соответствует минимальная энергия системы (см. рис. 1, б, кривая IV) и, следовательно, наиболее устойчивое состояние. Глубина «потенциальной ямы» представляет энергию связи Е0Н–Н в молекуле Н2 при абсолютном нуле. Она составляет 458 кДж/моль=4,5 эВ. Однако при реальных температурах на разрыв связи требуется несколько меньшая энергия ЕН–Н, которая при 298К (25°С) равна 435 кДж/моль. Разность этих энергий в молекуле Н2 является энергией колебаний атомов водорода (Екол = Е0Н–Н – ЕН–Н = 458 – 435 = 23 кДж/моль=0,2 эВ).

Рис. 1. Зависимость сил взаимодействия атомов (а) и энергии системы (б) от расстояния между ядрами атомов в молекуле Н2
При сближении двух атомов водорода, содержащих электроны с параллельными спинами, энергия системы постоянно увеличивается (см. рис. 1, б, кривая V) и связь не образуется.
Таким образом, квантово-механический расчет дал количественное объяснение связи. При наличии у пары электронов противоположных спинов электроны двигаются в поле обоих ядер. Между ядрами появляется область с высокой плотностью электронного облака – избыточного отрицательного заряда, который стягивает положительно заряженные ядра. Из квантово-механического расчета следуют положения, являющиеся основой метода ВС:
1. Причиной связи является электростатическое взаимодействие ядер и электронов.
2. Связь образуется электронной парой с антипараллельными спинами.
3. Насыщаемость связи обусловлена образованием электронных пар.
4. Прочность связи пропорциональна степени перекрывания электронных облаков.
5. Направленность связи обусловлена перекрыванием электронных облаков в области максимальной электронной плотности.
Одним из важнейших понятий метода ВС является валентность. Численное значение валентности в методе ВС определяется числом связей, которые атом образует с другими атомами.
Рассмотренный для молекулы Н2 механизм образования связи парой электронов с антипараллельными спинами, принадлежавших до образования связи разным атомам, называется обменным. Если учитывать только обменный механизм, валентность атома определяется числом его неспаренных электронов.
Для молекул более сложных, чем Н2, принципы расчета остаются неизменными. К образованию связи приводит взаимодействие пары электронов с противоположными спинами. Результатом этого является увеличение электронной плотности в области перекрывания электронных облаков и стягивание ядер. Рассмотрим примеры.
В молекуле фтора F2 связь образована 2р-орбиталями атомов фтора:

Наибольшая плотность электронного облака у 2р-орбитали в направлении оси симметрии. Если неспаренные электроны атомов фтора находятся на 2рх-орбиталях, связь осуществляется в направлении оси х (рис. 2). На 2рy- и 2рz-орбиталях находятся неподеленные электронные пары, не участвующие в образовании связей (на рис. 2 заштрихованы). В дальнейшем такие орбитали изображать не будем.

Рис. 2. Образование молекулы F2
В молекуле фтороводорода НF связь образована 1s-орбиталью атома водорода и 2рх-орбиталью атома фтора:
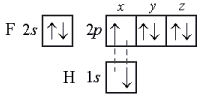
Направленность связи в этой молекуле определяется ориентацией 2рх-орбитали атома фтора (рис. 3). Перекрывание происходит в направлении оси симметрии х. Любой другой вариант перекрывания энергетически менее выгоден.
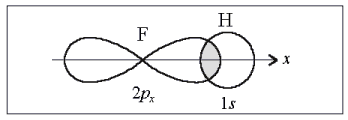
Рис. 3. Образование молекулы НF
Более сложные d- и f-орбитали также характеризуются направлениями максимальной электронной плотности вдоль осей их симметрии.
Таким образом, направленность – одно из основных свойств ковалентной связи.
Направленность связи хорошо иллюстрирует пример молекулы сероводорода Н2S:

Поскольку оси симметрии валентных 3р-орбиталей атома серы взаимно перпендикулярны, то следует ожидать, что молекула Н2S должна иметь уголковую структуру с углом между связями S–Н 90° (рис. 4). Действительно, угол близок к расчетному и равен 92°.
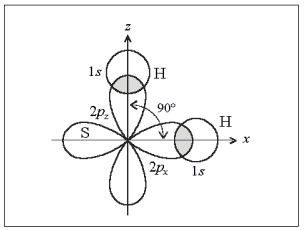
Рис. 4. Образование молекулы Н2S
Очевидно, что число ковалентных связей не может превышать числа образующих связи электронных пар. Однако насыщаемость как свойство ковалентной связи означает также, что если атом имеет некоторое количество неспаренных электронов, то все они должны участвовать в образовании ковалентных связей.
Это свойство объясняется принципом наименьшей энергии. При образовании каждой дополнительной связи выделяется дополнительная энергия. Поэтому все валентные возможности реализуются полностью.
Действительно, устойчива молекула Н2S, а не НS•, где имеется нереализованная связь (неспаренный электрон обозначают точкой). Частицы, содержащие неспаренные электроны, называют свободными радикалами. Они чрезвычайно реакционноспособны и вступают в реакции с образованием соединений, содержащих насыщенные связи.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 520; Нарушение авторских прав?; Мы поможем в написании вашей работы!