
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Комплексные соединения и их строение
|
|
|
|
Устойчивость комплексных соединений (самостоятельно)
Связь в комплексных соединениях
Название и классификация комплексных соединений
Комплексные соединения и их строение
Существует большой класс химических веществ, которые образованы в результате соединения друг с другом нейтральных молекул без образования связывающих электрических пар: СuSO4 + 5Н2O = СuSO4*5Н2O.
Они диссоциируют в растворе с образованием простых ионов. Но часть из таких веществ диссоциируют с образованием сложных (комплексных) соединений. То есть молекулярные соединения, образующие комплексные ионы, способные существовать как в растворе, так и в кристалле, называется комплексными: К3[Fе(СN)6] «3К++ [Fе(СN)6]3-.
Основополагающие представления о комплексных соединениях ввел в науку швейцарский ученый Альфред Веринер (1898). По Вернеру, в большинстве комплексных соединений различают внутреннюю и внешнюю сферы. Например, в КС К2[ВеF4] внутреннюю сферу составляют [ВеF4]2-, а внешнюю 2K+. Центральный атом внутренней сферы называется комплексообразователем (Ве), координированные вокруг него ионы - лигандами.
В современной лабораторной практике чаще всего имеют дело с соединениями в твердом и растворенном состоянии. Для этих условий можно дать следующие определение: комплексными соединениями называют соединения, способные к самостоятельному существованию в растворе.
По характеру электрического заряда различают катионные, анионные и нейтральные комплексы. Катионный комплекс можно рассматривать как образованный в результате координации вокруг положительного иона нейтральных молекул (Н2О, NH3), например [А1(Н2O)б]3+. В анионном комплексе в роли комплексообразователя выступает атом с положительной степенью окисления, а лигандами являются атомы с отрицательной степенью окисления (анионы), например, [ВеF4].
Нейтральные комплексы образуются при координации вокруг атома молекул, а так же при одновременной координации вокруг иона комплексообразователя отрицательных ионов и молекул, например [Рt (NH3)2С12]°.
Рассмотрим строение сложного комплексного соединения К3[Fе(СN)6], оно может быть изображено:
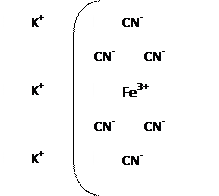 |
K+
K+
3К+ - составляют внешнюю сферу комплекса так как внутренняя сфера заряжена (-)-то это анионный комплекс. ион Fе3+ – ион комплексообразователь, 6СN- - лиганды. Причем, число лигандов скоординированных вокруг иона комплексообразователь называется координационным числом. В данном случае оно равно 6.
Ионами комплексообразователя являются как правилоd - элементы из периодической системы Менделеева: Аg+, Аu+, Сu+, Сu2+, Нg2+, Zn2+, Fе2+, Fе3+, Со3+, Ni 2+, Рt 4+ и другие. Комплексообразователями могут быть и некоторые неметаллы, например Н2[Si F6].
Координационные числа ионов комплексообразователей имеют следующие значения:
2: Аg+, Аu+, Сu+.
4: Сu2+, Нg2+, Аu3+, Сd2+, Рb2+ Рt 2+ Рd 2+.
6: Fе2+, Fе3+, Сr3+, Сo2+, Ni 2+, А13+, Zn2+, Рt 4+, Рb4+.
8: Са2+, Sr2+, Ва2+.
Заряд комплексного иона равен алгебраической сумме зарядов иона комплексообразователя и лигандов.
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 581; Нарушение авторских прав?; Мы поможем в написании вашей работы!