
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительные потенциалы
|
|
|
|
Чтобы уравнять число атомов кислорода, а затем атомов водорода в щелочной среде, необходимо в ту часть уравнения полуреакции, где недостаёт n атомов кислорода, вписать 2n гидроксид-ионов ОН-, а в противоположную часть n молекул воды.
· Уравниваем заряды левой и правой частей уравнений полуреакций:
Mn2+ + 4OH– –2 = MnO2 + 2H2O,
= MnO2 + 2H2O,
ClO– + H2O + 2 = Cl– + 2OH–,
= Cl– + 2OH–,
т.е. первая полуреакция - окисление восстановителя, вторая восстановление окислителя.
· Суммируем уравнения полуреакций:
 |
Mn2+ + 4OH– –2 = MnO2 + 2H2O 1
= MnO2 + 2H2O 1
ClO– + H2O + 2 = Cl– + 2OH– 1
= Cl– + 2OH– 1
 |
Mn2+ + ClO– + 4OH– + H2O = MnO2 + Cl– + 2H2O + 2OH–
· Приводим подобные члены:
Mn2+ + ClO– + 2OH– = MnO2 + Cl– + H2O.
Молекулярное уравнение:
MnSO4 + KClO + 2NaOH = MnO2 + KCl + H2O + Na2SO4.
Пример 3. Реакция между перманганатом калия и нитритом натрия в нейтральной среде:
KMnO4 + NaNO2 + H2O ® MnO2 + NO3– + ….
Будем придерживаться рекомендованной ранее последо-вательности операций.
· В ионную схему можно не включать молекулы и ионы, не участвующие в полуреакциях:
MnO4- + NO2- + H2O ® MnO2 + NO3– +….
· Схемы полуреакций:
MnO4- ® MnO2,
NO2- ® NO3–.
· При составлении уравнений реакций, протекающих в нейтральной среде, необходимо иметь в виду, что в левой части уравнений полуреакций не должно быть ионов Н+ и ОН-, а в правой части эти ионы можно использовать.
Соответствующие уравнения полуреакций:
MnO4- + 2H2O + 3 ® MnO2 + 4OH–
® MnO2 + 4OH–
NO2- + H2O – 2 ® NO3- + 2H+
® NO3- + 2H+
Таким образом, в нейтральной среде число атомов кислорода и водорода уравнивают по-разному, в зави-симости от того, в какую часть полуреакции необходимо ввести недостающие атомы. Если в правой части уравнения полуреакции недостаёт n атомов кислорода, в неё следует добавить 2n гидроксид-ионов, а в левую часть – n молекул воды. Если в левой части уравненияполуреакции недостаёт n атомов кислорода, в неё следует добавить n молекул воды, а в правую часть – 2n ионов водорода.
· Суммируем уравнения полуреакций:
 MnO4- + 2H2O + 3
MnO4- + 2H2O + 3 ® MnO2 + 4OH– 2
® MnO2 + 4OH– 2
NO2- + H2O – 2 ® NO3- + 2H+ 3
® NO3- + 2H+ 3
 |
2MnO4- +3NO2- + 4H2O + 3H2O = 2MnO2 + 3NO3– + 8OH- + 6H+
 |  |
7H2O 6H2O+2OH-
· После объединения ионов OH- и H+ в молекулы воды приводим подобные члены и получаем ионное уравнение реакции:
2MnO4- + 3NO2- + H2O = 2MnO2 + 3NO3– + 2OH-,
молекулярное уравнение:
2KMnO4 + 3NaNO2 + H2O = 2MnO2 + 3NaNO3 + 2KOH.
Представим схематически уравнивание числа атомов кислорода и водорода в различных средах, (обозначаем 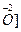 - атом кислорода в составе сложной частицы):
- атом кислорода в составе сложной частицы):
кислая среда - 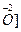 + 2Н+ = Н2О,
+ 2Н+ = Н2О,
Н2О = 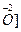 + 2Н+;
+ 2Н+;
щелочная среда - 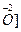 + Н2О = 2ОН-,
+ Н2О = 2ОН-,
2ОН- = 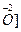 + Н2О;
+ Н2О;
нейтральная среда 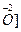 + Н2О = 2ОН-,
+ Н2О = 2ОН-,
Н2О = 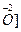 + 2Н+.
+ 2Н+.
Очевидно, что для уравнивания числа атомов кислорода существует всего два отличающихся приёма: добавление в ту часть уравнения полуреакции, где недостаёт n атомов кислорода, 2n гидроксид-ионов (если это позволяет данная среда), или n молекул воды.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 439; Нарушение авторских прав?; Мы поможем в написании вашей работы!