
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закономерности в изменении свойств элементов-неметаллов
|
|
|
|
Электронное строение элементов-неметаллов
Практически все элементы-неметаллы на внешнем энергетическом уровне имеют большое число электронов – от 4 до 7. Элемент бор – аналог алюминия, у него всего 3 электрона на внешнем энергетическом уровне, но он имеет малый радиус, прочно удерживает свои электроны и имеет свойства неметалла. Особо отметим электронное строение водорода. Это s-элемент, но он довольно легко принимает один электрон, образует гидрид-ион и проявляет окислительные свойства металла.
Электронные конфигурации валентных электронов элементов-неметаллов приведены в таблице:
| 1s1 | 2s22p1 | ns2np2 | ns2np3 | ns2np4 | ns2np5 |
| H | |||||
| B | C | N | O | F | |
| Si | P | S | Cl | ||
| As | Se | Br | |||
| Te | I | ||||
| At |
Рассмотрим некоторые закономерности в изменении свойств элементов-неметаллов, принадлежащих одному периоду и одной группе на основании строения их атомов.
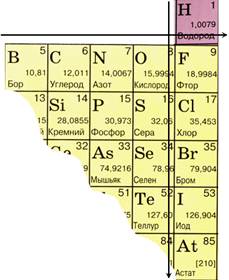
В периоде:
- заряд ядра увеличивается,
- радиус атома уменьшается,
- число электронов на внешнем энергетическом уровне увеличивается,
- электроотрицательность увеличивается,
- окислительные свойства усиливаются,
- неметаллические свойства усиливаются.
В группе:
- заряд ядра увеличивается,
- радиус атома увеличивается,
- число электронов на внешнем энергетическом уровне не изменяется,
- электроотрицательность уменьшается,
- окислительные свойства ослабевают,
- неметаллические свойства ослабевают.
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 1032; Нарушение авторских прав?; Мы поможем в написании вашей работы!