
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Задачи для самостоятельного решения
|
|
|
|
Примеры решения задач
Задача 1. Запишите уравнения окислительно-восстановительных реакций с участием неметаллов, укажите окислитель и восстановитель:
а) Cl2 + H2O 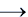
б) C + 2H2SO4 (конц.) 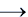
Решение:
А) При взаимодействии хлора с водой образуются хлороводородная и хлорноватистая кислоты:
Cl20 + H2O = HCl- + HCl+O.
Эта реакции является реакцией диспропорционирования, где хлор одновременно является окислителем и восстановителем. Запишем полуреакции:
Cl2 + 2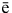
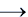 2Cl- (Cl2 – окислитель),
2Cl- (Cl2 – окислитель),
Cl2 + 2H2O - 2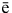
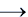 2ClO- + 4H+ (Cl2 – восстановитель).
2ClO- + 4H+ (Cl2 – восстановитель).
Б) При взаимодействии углерода с концентрированной серной кислотой образуются оксид углерода (IV), оксид серы (IV) и вода:
C0 + 2H2S+6O4 = C+4O2 + 2S+4O2 + 2H2O.
Углерод изменяет степень окисления от 0 до +4, а сера – от +6 до +4, полуреакции имеют вид:
SO42- + 4H+ + 2 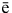
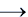 SO2 + 2H2O (S+6 – окислитель),
SO2 + 2H2O (S+6 – окислитель),
C0 + 2H2O - 4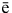
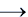 CO2 + 4H+ (C0 – восстановитель).
CO2 + 4H+ (C0 – восстановитель).
Задача 2. При взаимодействии серы с концентрированной азотной кислотой (w (HNO3) = 60 %, плотность раствора 1,27 г/мл) образовались серная кислота и оксид азота (II) объемом 67,2 л (н. у.). Вычислите массу серы и объем раствора азотной кислоты, вступивших во взаимодействие.
Дано:
ω (HNO3) = 60 %
ρ (р-ра) = 1,27 г/мл
V (NO) = 67,2 л (н. у.)
М (S) = 32 г/моль
М (HNO3) = 63 г/моль
Найти:
m (S)
V (р-ра HNO3)
Решение:
Запишем уравнение реакции взаимодействия серы с концентрированной азотной кислотой; по условию задачи образуется оксид азота (II) и серная кислота:
S + 2HNO3 = 2NO + H2SO4.
Для определения массы серы и объема азотной кислоты, взятой для окисления серы, необходимо знать количество вещества (в моль) образовавшегося оксида азота (II). Для расчета количества газа используем понятие молярный объем: при нормальных условиях 1 моль любого газа занимает объем, равный 22,4 л. Тогда:
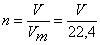 ,
,
где n – количество вещества, моль; V – объем газа при нормальных условия, л; Vm – молярный объем газа, равный при нормальных условиях 22,4 л.
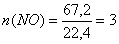 моль.
моль.
Вычислим массу серы, необходимую для взаимодействия. По уравнению химической реакции из 1 моль серы образуется 2 моль оксида азота (II), то есть соотношение n (S): n (NO) = 1: 2. тогда для образования 3 моль оксида азота (II) необходимо 1,5 моль серы. Количество вещества связано с массой вещества соотношением:
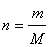 ,
,
где n – количество вещества, моль; m – масса вещества, г; М – молярная масса вещества, г/моль.
Тогда масса серы равна:
m (S) = n (S) · M (S) = 1,5 · 32 = 48 (г).
Для расчета объема азотной кислоты необходимо знать её количество. По уравнению реакции для образования 2 моль оксида азота (II) необходимо 2 моль азотной кислоты, то есть соотношение n (NO): n (HNO3) = 1: 1. По условию задачи образовалось 3 моль оксида азота (II), следовательно, азотной кислоты прореагировало 3 моль. Определим массу азотной кислоты:
m (HNO3) = n · M = 3 · 63 = 189 (г).
Вычислим массу раствора азотной кислоты, зная массовую долю HNO3 в растворе. По определению:
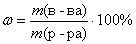 , тогда
, тогда
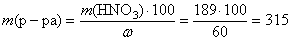 (г).
(г).
Определим объем раствора 60 %-ной азотной кислоты, необходимый для взаимодействия:
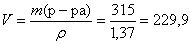 (мл).
(мл).
Ответ: V (р-ра HNO3) = 229,9 мл; m (S) = 48 г.
1. Запишите уравнения окислительно-восстановительных реакций с участием неметаллов, укажите окислитель и восстановитель:
а) Cl2 + NaOH
б) S + NaOH
в) C + HNO3
г) O2 + F2
2. Запишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
С → СО → СО2 → NaHCO3 → Na2CO3 → CO2.
3. При взаимодействии фосфора с концентрированной азотной кислотой (ω = 60 %, плотность раствора 1,37 г/мл) образовались ортофосфорная кислота и оксид азота (II) объемом 11,2 л (н.у.). Вычислите массу фосфора и объем раствора азотной кислоты, вступивших во взаимодействие. Ответ: V(р-ра) = 38,3 мл; m(Р) = 9,3 г.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 325; Нарушение авторских прав?; Мы поможем в написании вашей работы!