
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Комплексные соединения в биологи и медицине. Классификация комплексных соединений
Классификация комплексных соединений
а) Неэлектролиты [Pt(NH3)2Cl2], [Co(NH3)3(NO2)3]
Электролиты – соли, основания, кислоты
[Zn(NH3)4]Cl2; [Zn(NH3)4](OH)2; H4[Fe(CN)6]
б) По природе центрального атома: комплексы s -, p -, d -элементов. d -Элементы наиболее типичные комплексообразователи. Они образуют комплексы как с монодентатными, так и с полидентатными лигандами. Среди комплексов p -элементов есть центральные атомы как металлов, так и неметаллов: K[PF6], K[BiI4].
До середины прошлого века не были известны комплексы s -элементов. В 1946 г. (Шварценбах, Швейцария) были открыты органические вещества, названные комплексонами, способные прочно связывать в комплексы двухзарядные ионы s -элементов Be2+–Ba2+. Приблизительно на 20 лет позднее начала быстро развиваться химия комплексных соединений с макроциклическими лигандами. Эти лиганды дают прочные комплексы с ионами щелочных металлов, которые вообще не образуют комплексы с обычными лигандами. Отметим, что ионы щелочных металлов часто встречаются в составе комплексных соединений, но они находятся во внешней сфере, не являясь комплексообразователями. Применение макроциклических лигандов изменило представление о ионах щелочных металлов как не способных к комплексообразованию. Итак, все ионы металлов могут быть центральными атомами к комплексах.
в) По природе лигандов
Анионные и молекулярные лиганды. NH3, NO2–
Природа донорного атома: галогены, кислород, сера, азот, фосфор, углерод. Среди перечисленных атомов есть жесткие и мягкие доноры.
Монодентатные лиганды – образующие одну связь: ионы галогенов Х–, CN–, NO2–, S2O32–, NH3, CH3NH2.
Полидентатные лиганды – образующие две или более связей (хелатные комплексы, внутрикомплексные, комплексонаты, комплексы с макроциклическими лигандами).
К полидентатным лигандам относятся полиамины (NH2CH2CH2NH2), Ионы многоосновных карбоновых кислот (оксалат C2O42–, цитрат С6Н5О73–), ионы аминокислот. Простейший пример комплекса с ионом аминокислоты – глицинат меди [Cu(NH2CH2COO)2]. Такого типа соединения называют внутрикомплексными. Подразумевается, что когласно химической формуле это обычная соль. Однако отсутствие диссоциации в растворе означает, что это комплексное соединение.
Широкое применение получили комплексы с более сложными аминокислотами, называемые комплексонами. К их числу относится этилендиаминтетрауксусная кислота. Ее анион – этилендиаминтетраацетат
(–O2CCH2)2NH2CH2CH2NH2(CH2CO2–)2, образует с ионами металлов до 6 связей через азот и кислород.
В 70-х годах прошлого столетия началось бурное развитие химии макроциклических комплексов. Можно назвать несколько типичных разновидностей макроциклических молекул:
|




|


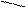 ОСН2СН2ОСН2СН2ОСН2СН2ОСН2СН2О
ОСН2СН2ОСН2СН2ОСН2СН2ОСН2СН2О
– циклические пептиды. Донорные атомы – кислород карбонильных групп
– циклические полиамины;
– производные порфина – макроцикла с четырьмя донорными атомами азота и ароматическим комплектом π-электронов (молекула плоская)

Это родоначальная структура многих природных соединений. Так в гемоглобине железо комплексуется в центре протопорфирина, отличающегося наличием радикалов, замещающих некоторые атомы водорода у атомов углерода. В других соединениях в прогалине макроцикла связаны магний, кобальт и, возможно, другие атомы металлов. В случае железа, имеющего КЧ 6, остаются свободными 2 координационных положения. Одна связь образуется с азотом белка в радикале гистидина. Этой связью макроцикл присоединяется к белку глобину. По оставшейся связи обратимо присоединяется кислород. В похожих комплексах, являющихся ферментами, образуются две связи с белком. Получаются изумительные по прочности и функциональным свойствам молекулярные конструкции.
Дальнейшим развитием идеи макроциклов являются криптанды – молекулы, имеющие внутри уже не прогалину, а полость. Ограничимся одним примером. В молекуле криптанда между двумя атомами азота имеются 3 цепочки из групп С2Н4 и атомов кислорода. Цепочки создают полость, в которой связываются ионы металлов.

В криптандах можно целенаправленно изменять число и природу донорных атомов. Например, на место жестких атомов кислорода можно вводить мягкие атомы серы. Так формируется избирательность к комплексованию металлов разной природы.
1. Образование и реакции комплексных соединений.
Мы ограничимся рассмотрением реакций образования комплексных соединений в водных растворах. Следует учитывать, что молекулы воды представляют собой один из обычных лигандов в комплексных соединениях. Поэтому образование комплексов в водных растворах, по существу, представляет собой замещение молекул воды в аквакомплексах на другие молекулы и ионы.
Рассмотрим образование комплексных соединений меди в водном растворе сульфата меди CuSO4. Раствор имеет голубой цвет вследствие присутствия гидратированных ионов меди, представляющих собой аквакомплексы [Cu(H2O)4]2+ и [Cu(H2O)6]2+ Для ионов Cu2+ характерно координационное число 4, но оно может повышаться и до 6. Для дальнейших рассуждений это не имеет принципиального значения. Ион SO42– в составе соли связывается с ионом меди слабее, чем молекулы воды, и присутствует в растворе в свободном виде. При добавлении к этому раствору избытка аммиака окраска становится интенсивной сине-фиолетовой. Вода в аквакомплексе замещается на аммиак:
[Cu(H2O)4]2+ + 4NH3 = [Cu(NH3)4]2+ + 4H2O
Легко доказать обратимость этой реакции. При добавлении раствора HCl избыток аммиака вступает в реакцию, комплекс начинает терять аммиак, который замещается на воду; раствор возвращается к исходной окраске. Если для проведения реакции вместо аммиака взять раствор этилендиамина, то образуется более прочный хелатный комплекс меди. Окраска раствора темно синяя.

 CH2NH2 NH2CH2
CH2NH2 NH2CH2
 [Cu(H2O)4]2+ + 2NH2(CH2)2NH2 = Cu2+ + 4H2O
[Cu(H2O)4]2+ + 2NH2(CH2)2NH2 = Cu2+ + 4H2O
CH2NH2 NH2CH2
Комплексные соединения могут образовываться непосредственно при окислении металлов d -блока 5 и 6 периодов в присутствии лигандов, способствующих окислению.
Золото окисляется кислородом в присутствии цианида. Получаемый раствор дицианоаурата(I) калия бесцветен.
4Au + O2 + 8KCN + 2H2O = 4K[Au(CN)2] + 4KOH
Платина окисляется азотной кислотой в присутствии соляной кислоты. Хлороводород так же играет роль комплексообразователя, способствующего окислению.
Pt + 2HNO3 + 6HCl = H2[PtCl6] + NO2↑ + NO↑ + 3H2O
Следует обратить внимание на то, что продуктом реакции является комплексная кислота. Раствор имеет интенсивный желто-оранжевый цвет.
Обычными для комплексных соединений являются реакции обмена ионов внешней сферы, которые идут при выполнении тех же условий, как и ионообменные реакции обычных солей, оснований и кислот. Например, при добавлении хлорида калия к раствору платинохлороводородной кислоты выпадает малорастворимая соль гексахлороплатинат калия желтого цвета:
H2[PtCl6] + 2KCl = K2[PtCl6]↓ + 2HCl
|
|
|
|
У атома железа КЧ 6 при изменении степени окисления сохранилось. Но в случае платины уменьшение степени окисления от 4 до 2 повлекло за собой уменьшение КЧ от 6 до 4. Это связано с особенностями электронной структуры центральных атомов.
В комплексных соединениях могут окисляться и лиганды. Например, при действии перекиси водорода на светлозеленый раствор триоксалато-феррата(III) калия образуется бурый осадок гидроксида железа:
K3[Fe(C2O4)3] + 3H2O2 = Fe(OH)3↓ + 6CO2↑ + 3KOH
Лиганды могут проявлять свойства, отсутствующие у соответствующих молекул в свободном состоянии. Известно, что аммиак в растворе не реагирует со щелочью, то есть не отдает протон. Но комплексное соединение [Pt(NH3)2(CN)4] проявляет свойства слабой кислоты:
[Pt(NH3)2(CN)4] + KОН = K[Pt(NH2)(NH3)(CN)4] + Н2О
Специфическими для комплексных соединений являются реакции замещения лигандов (РЗЛ). Сущность их заключается в замене всех или только части имеющихся в комплексе лигандов, на ионы и молекулы, которые становятся на место прежних лигандов. Направление процесса замещения определяется прочностью связей: лиганды с менее прочными связями M – L замещаются на лиганды с более прочными связями.
Если замещение лигандов идет быстро, то соответствующие комплексы называются лабильными. В случае медленного замещения лигандов комплексы называются инертными. Скорость РЗЛ определяется электронной структурой центрального атома. Образование инертных комплексов характерно для кобальта(III), хрома(III), платины(II), платины(IV) и ряда других.
Химические свойства инертных комплексов оказываются очень разнообразными, так как легко могут образовываться смешаннолигандные (смешанные) комплексы и изомеры, характеризующиеся различным размещением лигандов во внутренней сфере. Рассмотрим образование смешанных комплексов на примере получения изомеров дихлородиммминплатины, один из которых применяется как лекарственное средство.
При действии концентрированного раствора аммиака на красный раствор тетрахлороплатината(II) калия в течение нескольких часов происходит осаждение желтого осадка цис -дихлородиамминплатины:

 Cl– NH3
Cl– NH3

 K2[PtCl4] + 2NH3 = Pt2+ + 2KCl
K2[PtCl4] + 2NH3 = Pt2+ + 2KCl
Cl– NH3
Осадок отфильтровывают и очищают перекристаллизацией. Комплекс может реагировать с избытком аммиака, образуя тетрамминплатина(II)-ион:
цис -[Pt(NH3)2Cl2] + 2NH3 = [Pt(NH3)4]2+ + 2Cl–
цис -Дихлородиамминплатина известна с 1851 г. Она была получена итальянским химиком Пейроне, и упоминалась в статьях по химии под его именем. Она применялась как исходное вещество для синтеза многих других комплексных соединений платины. В 1969 г. Б. Розенбергом с сотрудниками (США) была открыта цитостатическая активность цис -[Pt(NH3)2Cl2]. В присутствии этого вещества резко замедлялось деление бактериальных клеток. Возникло предположение, что вещество может обладать противоопухолевым действием. Вскоре развернулись исследования биологической активности соли Пейроне и других комплексных соединений платины. Под кратким обозначением ДДП и фирменным названием «платин» цис -дихлородиаммин-платина заняла ведущее положение среди противоопухолевых лекарственных средств. Исследованию этого комплекса посвящены тысячи научных статей.
Изомер соли Пейроне, то есть транс-дихлородиамминплатина (соль Рейзе), получается длительным нагреванием хлорида тетрамминплатины(II) с концентрированной соляной кислотой:
H3 N Cl–
N Cl–
[Pt(NH3)4]Cl2 + 2HCl = Pt2+ + 2NH4Cl
Cl– NH3
транс -Дихлородиамминплатина цитостатической активности не проявляет.
В образовании двух разных изомеров [Pt(NH3)2Cl2] проявляется важная закономерность в химии комплексных соединений, открытая в 1926 г. И.И. Черняевым, и названная им закономерностью трансвлияния. Некоторый лиганд в комплексах с квадратной конфигурацией сильно влияет на скорость замещения другого лиганда, находящегося к нему в транс-положении, и очень слабо влияет на лиганды в цис-положении. Любой из лигандов Cl– в [PtCl4]2– влияет на лиганд в транс-положении, в результате чего в реакции с аммиаком относительно быстро образуется [PtNH3Cl3]–. Молекула аммиака проявляет слабый трансэффект, и по этой причине второй лиганд Cl– замещается в оставшемся фрагменте Cl–Pt–Cl. Получается цис-изомер:

Два оставшихся лиганда Cl– замещаются при слабом трансвлиянии аммиака медленнее, что способствует накоплению в качестве продукта реакции цис -дихлородиамминплатины. При замещении NH3 на Cl– в [Pt(NH3)4]2+ реакция идет очень медленно. После замещения первой молекулы NH3, вторая молекула замещается под трансэффектом Cl–, и образуется транс-изомер:

Таким образом, взаимное влияние лигандов приводит к образованию различных пространственных изомеров комплексных соединений. Это явление широко используется в синтезе комплексов заданного строения.
2. Устойчивость комплексных соединений в растворах.
Рассмотрим поведение комплексных соединений в водных растворах. Растворимые комплексные соли ведут себя как сильные электролиты, то есть практически полностью диссоциируют на ионы внутренней и внешней сферы:
[Co(NH3)6]Cl3 = [Co(NH3)6]3+ + 3Cl–
Напишем также диссоциацию анионного комплекса:
K2[PtCl4] = 2K+ + [PtCl4]2–
Комплексные катионы, анионы и молекулы в растворах не являются абсолютно устойчивыми частицами. В большей или меньшей степени они распадаются на свободные ионы (молекулы) лигандов и центральный атом. Эти реакции распада обратимы, и протекают ступенчато. Рассмотрим реакции распада на примере катионного комплекса [Zn(NH3)4]2+. При отщеплении каждого лиганда в растворе его место занимает молекула воды, но для сокращения записи молекулы воды обычно не пишут.
 [Zn(NH3)4]2+ [Zn(NH3)3]2+ + NH3, K 1 = 1,1∙10–3
[Zn(NH3)4]2+ [Zn(NH3)3]2+ + NH3, K 1 = 1,1∙10–3
 [Zn(NH3)3]2+ [Zn(NH3)2]2+ + NH3, K2 = 4,9∙10–3
[Zn(NH3)3]2+ [Zn(NH3)2]2+ + NH3, K2 = 4,9∙10–3
 [Zn(NH3)2]2+ [Zn(NH3)]2+ + NH3, K 3 = 5,6∙10–3
[Zn(NH3)2]2+ [Zn(NH3)]2+ + NH3, K 3 = 5,6∙10–3
 [Zn(NH3)]2+ Zn2+ + NH3, K 4 = 6,6∙10–3
[Zn(NH3)]2+ Zn2+ + NH3, K 4 = 6,6∙10–3
Константы равновесия, характеризующие каждую ступень распада комплекса, называют ступенчатыми константами нестойкости. Распад комплекса заканчивается образованием свободного (гидратированного) иона металла. Складывая ступенчатые реакции распада комплекса, получим суммарную реакцию и соответствующую ей константу нестойкости:
 [Zn(NH3)4]2+ Zn2+ + 4NH3, K н = K 1∙ K 2∙ K 3∙ K 4 = 2,0∙10–10
[Zn(NH3)4]2+ Zn2+ + 4NH3, K н = K 1∙ K 2∙ K 3∙ K 4 = 2,0∙10–10
К каждому из написанных равновесий применим закон действующих масс (ЗДМ). Напишем уравнения для первой стадии распада и суммарной реакции распада [Zn(NH3)4]2+:

 (14.1)
(14.1)
По уравнениям такого типа можно рассчитывать концентрации свободных ионов металла и молекул (ионов) лиганда. Следует учитывать, что для повышения точности расчетов в уравнения следует подставлять активности веществ и ионов. Для достаточно разбавленных растворов вполне допустимо использовать концентрации (моль/л).
Константы нестойкости определены для многих комплексных соединений. Они могут относиться к отдельным стадиям распада (ступенчатые константы нестойкости Ki) и к суммарной реакции (полная константа нестойкости K н). В справочных таблицах полную константу нестойкости часто обозначают индексом, показывающим число ступеней распада комплекса. В данном примере константа имела бы следующее обозначение: K 1-4.
Амминокомплекс платины [Pt(NH3)4]2+ характеризуется значением K 1-4 = 3,2∙10–21. Из сравнения с комплексом цинка следует, что последний менее устойчив на 11 порядков величины.
Чем меньше константа нестойкости, тем устойчивее комплексное соединение.
Реакции между свободными ионами металла и лигандом являются реакциями образования комплексов. Это обратные реакции по отношению к распаду комплексов. Для суммарой реакции константу образования принято обозначать β:
 Zn2+ + 4NH3 [Zn(NH3)4]2+,β = 1/ K 1–4= 5,0∙109
Zn2+ + 4NH3 [Zn(NH3)4]2+,β = 1/ K 1–4= 5,0∙109
|
Дата добавления: 2013-12-13; Просмотров: 2646; Нарушение авторских прав?; Мы поможем в написании вашей работы!