
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Адсорбция
Классификация поверхностей раздела
| Неподвижные | Подвижные |
| Т – Т | Ж – Ж |
| Т – Ж | Ж – Г |
| Т – Г |
Любая фаза имеет определенный запас энергии. На увеличение площади поверхности фазы требуется затрата работы. Следовательно, поверхность имеет некоторый избыток свободной энергии, то есть энергии Гиббса.
Поверхностная энергия – это избыток свободной энергии поверхностного слоя.
Силы, действующие на молекулы в поверхностном слое, не уравновешены, и имеют составляющую, направленную внутрь фазы (рис. 3). Энергия запасается в деформированных частицах поверхностного слоя (при упругой деформации повышается потенциальная энергия). Для поверхностной частицы имеется равнодействующая сил, направленная вглубь фазы.

Рис. 3. Силы, действующие на молекулу на поверхности и в объеме.
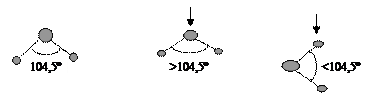
Рис. 4. Деформация молекул воды
Молекулы, находящиеся в поверхностном слое, совершают работу по преодолению ММВ. Это работа по образованию поверхности.
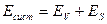
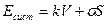
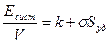 ;
; 
Работа образования поверхности
WS = – Δ GS = – σΔS
Поверхностное натяжение это сила, стремящаяся сократить поверхность, действующая на единицу длины контура, направленная перпендикулярно контуру и касательно к поверхности.
Коэффициент поверхностного натяжения σ численно равен работе, которая затрачивается на образование единицы площади поверхности, так как.

Капля (сфера) – это собственная форма жидкости, которую она принимает самопроизвольно под действием поверхностного натяжения, если этому не препятствуют внешние силы.
σ(H2O) 72,8·10–3 (293K); 74,22·10–3 (283K); 71,96·10–3 Дж·м–2 (Н·м–1) (298K);
σ(С6H6) 30·10–3 (293K); ртуть 436·10–3 Дж·м–2
Каждая жидкость характеризуется определенным значением коэффициента поверхностного натяжения, зависящим от температуры. Особенно велико поверхностное натяжение ртути.
Методы определения коэффициента σ: 1) по силе, уравновешивающей сокращение пленки; 2) капиллярный метод (поднятие или опускание жидкости в капилляре; 3) проскок пузырька воздуха (метод Ребиндера)

WS = – σ l 1Δ l 2 = σ Δ S
Рис. 5. Пленка жидкости в рамке с подвижной стороной a-b

Рис. 6. При увеличении давления р пузырек раздувается и при некотором значении р пр, пропорциональном поверхностному натяжению, отклоняется от капилляра и проскакивает на поверхность жидкости.
Адсорбция – это явление самопроизвольного изменения концентрации вещества в поверхностном слое раствора относительно концентрации в объеме (или просто концентрации; так как объем поверхностного слоя не сопоставим с объемом всего раствора). Изменение концентрации в поверхностном слое не влечет за собой изменение концентрации в объеме раствора.
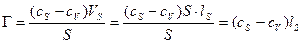
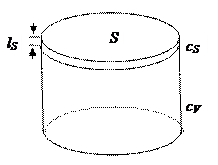
Рис. 7. К определению понятия адсорбции.
Γ > 0 положительная адсорбция; Γ < 0 отрицательная адсорбция.
Количественно адсорбция измеряется как избыточное количество вещества, приходящееся на единицу площади.
Поверхностно активные вещества (ПАВ) – вещества, уменьшающие поверхностное натяжение, у них адсорбция положительна. Примеры в водных растворах: молекулярные – спирты, амины, кислоты (RCOOH); ионогенные – соли органических кислот; желчные кислоты (уменьшают поверхностное натяжение воды до σ = 70·10–5 Дж·м–2).
Поверхностно не активные вещества (ПНВ) – не изменяют поверхностное натяжение.
Поверхностно инактивные вещества (ПИВ) – увеличивают поверхностное натяжение; это неорганические соли, основания. При концентрации NaOH 1 моль/л σ = 74,6·10–3 (вода 74,22·10–3). Видим из этого, что увеличение σ незначительно.

.Рис. 8. Изотерма адсорбции на подвижной поверхности раздела
Из соображений размерности адсорбция равна производной поверхностного натяжения по химическому потенциалу вещества:
 (Дж·дм–2/(Дж·моль–1) = моль·дм–2)
(Дж·дм–2/(Дж·моль–1) = моль·дм–2)
 ;
;  ;
;

Полученное уравнение называется уравнение Гиббса.
Производная – dσ/dc в уравнении Гиббса носит название поверхностная активность.
Уравнение Гиббса подвергалось экспериментальной проверке, которая подтвердила его правильность.
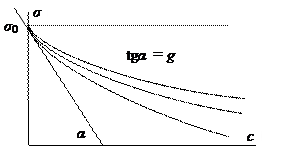
Рис. 9. Зависимость поверхностного натяжения от концентрации (изотермы поверхностного натяжения)

Рис. 10. Изотермы поверхностной активности.
Поверхностная активность равна тангенсу угла наклона касательной к изотерме поверхностного натяжения при концентрации стремящейся к нулю.
Факторы, влияющие на адсорбцию.
1) Температура; 2) Природа соприкасающихся фаз; 3) Природа растворенного вещества 4) Концентрация
Правило Дюкло-Траубе: В гомологических рядах адсорбция увеличивается в 3 – 3,5 раза (при малых концентрациях) на каждую группу СН2.
Зависимость адсорбции от концентрации – уравнение Лэнгмюра:
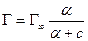
Предельная адсорбция – мономолекулярный слой ПАВ, так называемый частокол Лэнгмюра; α – константа адсорбционного равновесия.

Рис. 11. Мономолекулярная адсорбция.
Площадь адсорбционного слоя липидов из эритроцитов равна удвоенной суммарной поверхности эритроцитов (Е. Горшнер, Г. Грендел, 1925). Из этого следует, что клетки имеют мембрану, состоящую из двух слоев липидов и белков.
Модель биомембраны – двухслойный замкнутый объем.
Измерение адсорбции позволяет вычислить площадь поперечного сечения молекулы и длину молекулы.
Очевидно, что площадь, занимаемая молекулой в насыщенном слое

где N А – число Авогадро.
Длина молекулы численно равна объему адсорбированного вещества на единице площади мономолекулярного адсорбционного слоя:
 ,
,
где М – молярная масса адсорбированного вещества, р – плотность вещества.
Основное направление применения адсорбции на жидких поверхностях – это снижение поверхностного натяжения, изменение свойств поверхности. На этом основано действие моющих средств.
|
Дата добавления: 2013-12-13; Просмотров: 753; Нарушение авторских прав?; Мы поможем в написании вашей работы!