
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физико-химия дисперсных систем
|
|
|
|
Дисперсные системы мы видим вокруг себя, используем в хозяйстве, принимаем в пищу не реже, чем воду.
Мутная вода, утренний туман, дорожная пыль, дымок от папиросы, опал, гранит, мороженое, сухарь, безе, клеточные суспензии – все это примеры дисперсных систем.
Они изучаются в особой научной дисциплине – коллоидной химии. Изучая свойства смесей вода – хлорид серебра; вода – сера; вода – берлинская лазурь и др., итальянский ученый Ф. Сельми (1845) установил, что при определенных условиях они образуют гомогенные по внешнему виду системы, похожие на растворы. Однако, эти системы, в отличие от водных растворов хлорида натрия, сульфата меди и др. хорошо растворимых в воде веществ, самопроизвольно не образуются. Подобные системы Ф. Сельми предложил называть псевдорастворами.
Т. Грэм (1861) изучая подобные системы установил, что одни вещества (гидроксид калия, сульфат калия, сульфат магния, сахароза и др.) обладают способностью проходить через растительные и животные мембраны и большой скоростью диффузии, тогда как другие (белки, декстрин, желатин, карамель и др.) – малой скоростью диффузии и отсутствием способности проходить через мембраны.
Первая группа веществ достаточно легко кристаллизуется, в то время как вторая после удаления растворителя образует клееподобные массы. Первую Т. Грэм назвал коллоидами (от греч. κολλα – клей, λεδεσ – вид), а вторую – кристаллоидами. Кристаллоиды образуют истинные растворы, тогда как коллоиды – золи (коллоидные растворы).
В 1899 г. русский ученый И. Г. Борщов высказал предположение, что многие вещества, способные образовывать коллоидные растворы, имеют кристаллическое строение, и поэтому следует говорить не об особых веществах коллоидах, а об коллоидном состоянии.
В начале прошлого века профессор СПб горного института П. П. Веймарн экспериментально доказал, что подразделение на коллоиды и кристаллоиды весьма условно. Типичные кристаллоиды NaCl, KI и др. могут образовывать коллоидные растворы в подходящих растворителях, например, коллоидный раствор NaCl в бензоле.
Наконец, было доказано, что одно и то же вещество в одном и том же растворителе в зависимости от ряда условий может проявлять себя как коллоид, так и кристаллоид. Такие вещества было предложено называть полуколлоидами. Коллоидные растворы (коллоидные системы) являются частным случаем дисперсных систем.
Коллоидная химия – это специфическая отрасль химии, в которой химические реакции не главное. Особые свойства коллоидных систем проистекают от их высокой удельной поверхности и поверхностной энергии. Эти системы термодинамически неустойчивы. Но в некоторых случаях оказываются устойчивы кинетически. В Лондоне, говорят, хранятся коллоидные растворы золота, полученные М. Фарадеем более 150 лет тому назад.
Сложность дисперсных систем связана с различием составляющих их частиц по размерам и форме. Их свойства – результат статистического усреднения.
Дисперсная система – это гетерогенная система, состоящая из сплошной фазы (дисперсионной среды) и одной или нескольких раздробленных (дисперсных) фаз.
Размер частиц дисперсной фазы 10–7 – 10–9 м (100 – 1 нм). Именно эти системы могут быть кинетически устойчивы. При большем размере частиц получаются грубодисперсные си стемы. Они кинетически неустойчивы, в них наблюдается более или менее быстрое расслаивание – разделение на дисперсионную среду и дисперсную фазу. Широко известное явление – оседание (седиментация) твердых частиц в жидкости.

(Глобулы макромолекул по размерам сопоставимы с коллоидными частицами. Молекула гемоглобина имеет диаметр 5 нм)
Радиус атома 0,05 – 0,3 нм или 50 – 300 п. Коллоидная частица 1 – 100 нм
Коллоидная частица золота при (r атома = 0,146 нм) при диаметре 3,2 нм содержит» 1000 атомов.
Для характеристики раздробленности дисперсной фазы используют степень дисперсности δ, которая измеряется величиной, обратной среднему диаметру частиц d:

Следует также уяснить, что обычные или истинные растворы – это гомогенные системы и не относятся непосредственно к коллоидной химии, но в то же время дисперсионная среда – это всегда раствор, потому что она насыщена всеми компонентами, имеющимися в дисперсной фазе. Если это коллоидный раствор хлорида серебра, то в воде в соответствующей концентрации (которую мы умеем рассчитать) содержатся ионы серебра и хлора. Дисперсионная среда может содержать и любые растворенные вещества. Коллоидный раствор хлорида серебра может образоваться при наличии в жидкости хлорида натрия, нитрата серебра и разных других солей.
Что будет представлять собой система полученная доведением коллоидного раствора до состояния молекулярной дисперсности? – Это пересыщенный раствор.
Сравнение свойств грубодисперсных систем, коллоидных систем и растворов.
| Свойство | Грубодис- персные | Коллоидные | Истинные растворы |
| D G образования | ~0 | > 0 | < 0 (образуются самопроиз-вольно) |
| r (диаметр), нм | > 100 | 100 – 1 | < 1 |
| Число структурных единиц в частице | > 105 | 1000 - 10000 | < 1000 |
| Фильтрация через бумажный фильтр | нет | + | + |
| Фильтрация через мембраны | нет | нет | + |
| диализ | + | ||
| Наблюдение частиц в микроспоп | + | ± | Не наблюдаются |
| Седиментация | быстрая | Медленная или отсутствует | нет |
| Диффузия | нет | медленная | быстрая |
| Поверхностная энергия | мала | велика | - |
| Пропускание света | слабое | Избиратель- ное, рассеяние | Избиратель-ное |
Типы дисперсных систем (классификация).
Классификация дисперсных систем по агрегатному состоянию.
| Дисперсионная среда | Дисперсная фаза |
| Газ | Жидкая. Туман. Дождь. |
| Твердая. Дымы (военная завеса). Пылевое облако. Смог. Осажденная пыль. | |
| Жидкая | Газ. Пены. |
| Жидкая. Эмульсии. Дизельное топливо, разбавленное водой. Мембранные структуры. Легкое. | |
| Твердая. Суспензии. Коллоидные растворы. Золь – свободнодисперсная, гель – связаннодисперсная. Паста – суспензия или эмульсия с малым объемом среды. Мазь – система с вязкой средой | |
| Твердая | Газ. Пенопласт. Сухарь. Сухая кость. Жидкость. Опал. Пенопласт + вода. Живая кость. Твердая. Гранит. Многие сплавы. Застывшая эмульсия (парафин + вода). |
По наличию взаимодействия среда – фаза.
Лиофильные – имеется взаимодействие. В воде происходит гидратация, например, SiO2×xH2O.
Лиофобные – взаимодействие с растворителем слабое. К таким системам относятся коллоидные растворы металлов, практически нерастворимых солей: Аu, CuS.
|
|
|
|
|
|
|
Свободнодисперсные системы – золи.
|
Получение коллоиднодисперсных систем.
Для получения коллоидных растворов необходимо: 1) достичь коллоидной степени дисперсности; 2) подобрать дисперсионную среду, в которой нерастворимо вещество дисперсной фазы; 3) подобрать третий компонент – стабилизатор, сообщающий коллоидной системе устойчивость.
Образовывать коллоидные растворы в воде могут металлы, малорастворимые в ней оксиды, гидроксиды, кислоты, соли. В качестве стабилизаторов используют вещества, препятствующие агрегации (объединению) коллоидных частиц в более крупные и выпадению их в осадок.
По способу достижения коллоидной степени дисперсности различают методы (рис.)
– диспергационные (от лат. dispergire – измельчать) – получение частиц дисперсной фазы путем дробления более крупных частиц; применяется механическое измельчение, ультразвуковое измельчение, электроискровое измельчение, распыление пульверизатором.
– конденсационные (от лат. condensire – укрупнять) – получение частиц дисперсной фазы путем объединения атомов, молекул, ионов в среде жидкости или газа. Это достигается заменой растворителя или химической конденсацией.
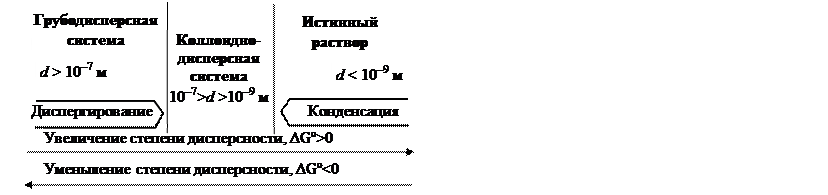
Коллоидные растворы, полученные одним из рассмотренных методов, содержат примеси растворенных низкомолекулярных веществ и грубодисперсных частиц, наличие которых может отрицательно сказываться на свойствах золей, снижая их устойчивость. Для очистки коллоидных растворов от примесей используют фильтрацию, диализ, электродиализ и ультрафильтрацию.
Фильтрация основана на способности коллоидных частиц проходить через поры обычных фильтров. При этом более крупные частицы задерживаются. Фильтрацию используют для очистки коллоидных растворов от примесей грубодисперсных частиц.
Диализ – удаление с помощью мембран истинно растворенных низкомолекулярных соединений из коллоидных растворов. При этом используют свойство мембран пропускать молекулы и ионы обычных размеров. Все диализаторы построены по общему принципу: диальзируемая жидкость находится во внутреннем сосуде, в котором она отделена от растворителя мембраной.

Рис. 2. Диализатор: 1 – диализуемая жидкость; 2– растворитель; 3–диализная мембрана; 4 – мешалка
Скорость диализа возрастает с увеличением поверхности мембраны, ее пористости и размера пор, с повышением температуры, интенсивности перемешивания, скоростью смены внешней жидкости и с уменьшением толщины мембран.
Для увеличения скорости диализа низкомолекулярных электролитов в диализаторе создают постоянное электрическое поле. Скорость диализа можно увеличить, если диализируемый раствор продавливать через мембрану (ультрафильтр). Такой способ очистки систем, содержащих частицы коллоидных размеров от растворов низкомолекулярных веществ называют ультрафильтрацией.
Дисперсные системы постоянно возникают в природе. Дым при извержении вулкана, туман при охлаждении влажного воздуха, потоки мутной воды в результате размывания почвы или горных массивов. Дисперсными системами являются клеточные структуры, кровь, костные ткани, молоко и т.д.
При диаметре частиц около 1 мкм седиментация в воде медленная
Капельки облаков 5 – 50 мкм
С поверхности океанов в виде пыли уносится 1010 т соли в год –это результат испарения воды и конденсации соли.
В коллоидных растворах могут существовать разные типы мицелл в зависимости от природы дисперсной фазы. Для лиофобных золей характерны мицеллы с кристаллической сердцевиной. Такая ультрамикрочастица носит название агрегат. На агрегате адсорбируются ионы, достраивающие структуру, и противоионы. Часть противоионов закреплена на частице, другая часть образует диффузионный слой (рой частиц вокруг гранулы). Все вместе называется мицеллой.
Строение коллоидной частицы:


 {m[AgI]×nI–(n–x)K+}x K+
{m[AgI]×nI–(n–x)K+}x K+
агрегат
ядро (агрегат с адсорбционным слоем)
гранула (ядро вместе со связанными противоионами)
мицелла (гранула и диффузионный слой)
Адсорбционный слой и противоионы создают скачок потенциала j.
Между гранулой и диффузионным слоем также имеется скачок потенциала, называемый электрокинетическим потенциалом z (дзета).
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 2677; Нарушение авторских прав?; Мы поможем в написании вашей работы!