
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ионная связь. Если соединяются элементы, электроотрицательность которых сильно различается, т.е. один из них относится к числу наиболее электроположительных элементов
|
|
|
|
Если соединяются элементы, электроотрицательность которых сильно различается, т.е. один из них относится к числу наиболее электроположительных элементов (типичный металл), а другой - к числу наиболее электроотрицательных элементов (типичный неметалл), то валентный электрон (или электроны) электроположительного атома полностью переходит к электроотрицательному атому, в результате чего атомы превращаются в заряженные частицы – ионы. Атом, отдавший электроны, превращается в положительный ион (катион), а атом, принявший электроны, – в отрицательный ион (анион). Связь при этом будет осуществляться за счет взаимного притяжения противоположно заряженных ионов. Отсюда ее название – ионная связь.
Ионная связь – связь, образующаяся между атомами, электроотрицательность которых сильно различается.
Как правило, ионные связи образуют между собой элементы начала и конца периодов таблицы Менделеева. Это объясняется тем, что что различные атомы в различной степени способны принимать на свои орбиты электроны. Элементы седьмой группы, имеющие на внешней орбите семь электронов, легко принимают один электрон, недостающий до полного октета. Элементы же первой группы имеют на внешней орбите всего один электрон, который они легко отдают. Пример: образование хлорида натрия. Атом электроположительного элемента натрия, характеризующегося сравнительно невысокой энергией ионизации, легко теряет внешний электрон. Атом электроотрицательного элемента хлора, обладающего значительным сродством к электрону, напротив, способен принять на внешний электронный уровень дополнительный электрон. За счет электростатического притяжения между ионами возникает ионная связь.
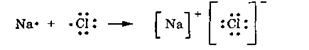 |
В противоположность ковалентной связи, ионная связь не обладает направленностью и насыщаемостью.
Ионы можно представить как заряженные шары, силовые поля которых равномерно распределяются во всех направлениях в пространстве. Поэтому каждый ион может притягивать к себе ионы противоположного знака в любом направлении, сила притяжения зависит только от зарядов ионов и расстояния между ними. Иначе говоря, ионная связь характеризуется ненаправленностью.
 Понятно, что взаимодействие друг с другом двух ионов противоположного знака не может привести к полной взаимной компенсации их силовых полей.
Понятно, что взаимодействие друг с другом двух ионов противоположного знака не может привести к полной взаимной компенсации их силовых полей.
В силу этого у них сохраняется способность притягивать ионы противоположного знака и по другим направлениям. К одному иону может притягиваться любое число ионов противоположного знака. Следовательно, ионная связь характеризуется ненасыщаемостью.
Ионная связь наиболее характерна для неорганических соединений. Отличительными чертами ионных соединений являются: мгновенность протекания реакций, диссоциация в водных растворах, высокие температуры плавления и кипения, растворимость в полярных растворителях, электрическая проводимость растворов и расплавов.
Отметим, что, если чисто ковалентная связь осуществима практически (например, в решетке алмаза, в молекуле водорода и т.п.), то ионная связь в чистом виде не встречается, т.к. величина потенциала ионизации атома даже наименее электроотрицательного элемента – Cs больше, чем значение сродства к электрону у наиболее электроотрицательного – F. Как следствие, во фториде цезия не происходит полной передачи электронов от Cs к F, а лишь на 93%. Это значит, что 7% времени связывающие электроны находятся в общем пользовании атомов данных элементов, т.е. связь на 7% ковалентная. В хлориде натрия связь лишь примерно на 80% ионная. Поэтому, уловились считать, что связь ионная, если ковалентная составляющая в ней менее 50%.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 478; Нарушение авторских прав?; Мы поможем в написании вашей работы!