
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Принцип Паули
|
|
|
|
В 1925 году Паули установил квантовомеханический закон, который был назван принципом Паули или принципом исключения: в любом атоме не может быть двух электронов, находящихся в двух одинаковых стационарных состояниях, определяемых набором четырех квантовых чисел: главного n, орбитального  , магнитного m и спинового m S
, магнитного m и спинового m S  .
.
Найдем максимальное число электронов с одинаковыми числам n,  , m – их 2, отличающихся
, m – их 2, отличающихся 
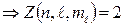 .
.
Вычислим максимальное число электронов с одинаковыми числами n,  . При этом вектор
. При этом вектор 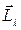 может иметь
может иметь 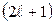 различных ориентаций:
различных ориентаций: 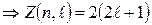 .
.
| s состояние | Z = 2 |
| p состояние | Z = 6 |
| d состояние | Z = 10 |
| f состояние | Z = 14 |
| g состояние | Z = 18 |
Найдем максимальное число электронов, имеющих одинаковое число n. Число  при этом изменяется от 0 до (n – 1):
при этом изменяется от 0 до (n – 1):  (при получении данного соотношения использовано, что
(при получении данного соотношения использовано, что 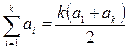 ).
).
| Количество электронов | Максимальное число электронов | ||||||
| n | s 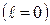
| p 
| d 
| f 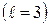
| g 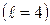
| ||
| K | – | – | – | – | |||
| L | – | – | – | ||||
| M | – | – | |||||
| N | – | ||||||
| O |
Систематика заполнения электронных состояний в атомах и периодичность изменения свойств химических элементов позволяют расположить все химические элементы в периодическую систему элементов Д.И.Менделеева.
Основные положения современной теории периодической системы:
1) порядковый номер Z химического элемента равен общему числу электронов в атоме данного элемента;
2) состояние электронов в атоме определяется набором четырех квантовых чисел: 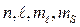 ;
;
3) с возрастанием числа электронов каждый следующий электрон должен занять возможное энергетическое состояние с наименьшей энергией;
4) заполнение электронами энергетических состояний в атоме должно происходить в соответствии с принципом Паули.
Электронным слоем называется совокупность электронных состояний в атоме с одинаковым значением главного квантового числа n: K при n =1; L при n =2; M при n =3; N при n =4; O при n =5 и т.д.
Нарушение указанного в таблице порядка начинается с Z = 19 и объясняется тем, что состояния с большими n и меньшими  могут быть энергетически более выгодными, чем состояния с меньшими n и большими
могут быть энергетически более выгодными, чем состояния с меньшими n и большими  . Поэтому возникают химические элементы с недостроенными предыдущими слоями.
. Поэтому возникают химические элементы с недостроенными предыдущими слоями.
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 349; Нарушение авторских прав?; Мы поможем в написании вашей работы!