
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение ван-дер-ваальса
|
|
|
|
РЕАЛЬНЫЕ ГАЗЫ
Уравнения молекулярно-кинетической теории довольно хорошо описывают поведение реальных газов при достаточно высокой температуре и низком давлении. Это и понятно, ведь такое состояние реального газа наиболее близко к модели идеального газа, на основе которой получены все выводы МКТ. Однако с ростом давления и понижением температуры среднее расстояние между молекулами уменьшается и силы молекулярного взаимодействия растут. Например, при н.у. объем молекул составляет 1/10000 от занятого газом объема, а при давлении 500 атм (500 МПа) он будет составлять уже половину всего объема газа. Совершенно очевидно, что при этих условиях законы МКТ перестает работать, например, PV ¹ const при Т = const.
Таким образом, задача заключается в том, чтобы получить такое уравнение состояния реального газа, которое бы учитывало объем молекул и их взаимодействие.
Из всех уравнений состояния реального газа, предложенных в свое время, самым простым и достаточно точным оказалось уравнение голландского физика Ван-дер-Ваальса:
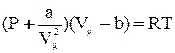
Как видно, оно получено из уравнения Клапейрона для моля идеального газа путем введения поправок. Константы а и b имеют различные значения для разных газов и определяются опытным путем. В СИ 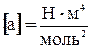 ,
, 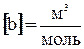 .
.
Поправка «b» определяет ту часть объема, занимаемого газом, которая недоступна для движения из-за конечных размеров самих молекул. b = 4 Vмолекул. УТОЧНИТЬ!
Поправка 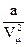 определяет внутренне давление р´, обусловленное взаимным притяжением молекул друг к другу. Очевидно, если бы вдруг это притяжение исчезло, то для того, чтобы удержать газ в пределах того же объема, пришлось бы увеличить внешнее давление на
определяет внутренне давление р´, обусловленное взаимным притяжением молекул друг к другу. Очевидно, если бы вдруг это притяжение исчезло, то для того, чтобы удержать газ в пределах того же объема, пришлось бы увеличить внешнее давление на
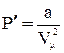 .
.
Для произвольного количества газа 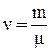 уравнение Ван-дер-Ваальса имеет вид:
уравнение Ван-дер-Ваальса имеет вид: 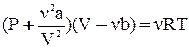 .
.
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 244; Нарушение авторских прав?; Мы поможем в написании вашей работы!