
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение кристаллического тела
|
|
|
|
Твердое тело – одно из четырех агрегатных состояний вещества, отличающееся от остальных стабильностью формы и характером теплового движения атомов, совершающих малые колебания около положений равновесия. Твердые тела можно поделить на кристаллические, аморфные и вещества, обладающие промежуточной степенью кристалличности. Кристаллы имеют упорядоченное симметричное строение. Для описания структуры кристалла использут понятия:
1. Кристаллическая решетка – пространственный каркас, образуемый воображаемыми пересекающимися линиями.
2. Узел кристаллической решетки – центр пересечения линий, где располагаются частицы, составляющие кристалл.
3. Элементарная ячейка кристалла – наименьшее число частиц, сохраняющее свойственный данной решетке порядок.
4. Дальний порядок – упорядоченность в расположении частиц, повторяющаяся на неограниченно больших расстояниях.
5. Ближний порядок – согласованность в расположении частиц на расстояниях, сравнимых с межатомными.
6. Ось симметрии – прямая линия, при повороте которой на неопределенный угол фигура совмещается сама с собой. Для кристаллов характерна ось симметрии 1, 2, 3, 4 порядка.
Элементарная ячейка характеризует особенности строения кристалла. Основными параметрами кристалла являются:
- размеры ребер элементарной ячейки. a, b, c – периоды решетки – расстояния между центрами ближайших атомов.
- углы между осями (α, γ, χ).
- координационное число указывает на число атомов, расположенных на ближайшем одинаковом расстоянии от любого атома в решетке.
- базис решетки (кратность) - количество атомов, приходящихся на одну элементарную ячейку решетки.
- плотность упаковки атомов в кристаллической решетке – объем, занятый атомами, которые условно рассматриваются как жесткие шары. Ее определяют как отношение объема, занятого атомами к объему ячейки (для объемно-центрированной кубической решетки – 0,68, для гранецентрированной кубической решетки – 0,74).
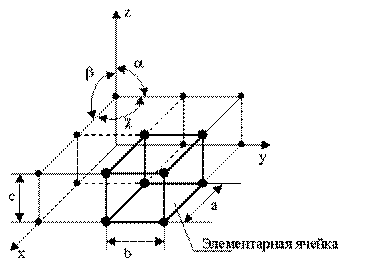
Рисунок 2.1 - Схема кристаллической решетки
Классификация возможных видов кристаллических решеток была проведена французским ученым О. Браве, соответственно они получили название «решетки Браве». Всего для кристаллических тел существует четырнадцать видов решеток, разбитых на четыре типа: (примитивный, базоцентрированный, объемно-центрированный, гранецентрированный).
Основными типами кристаллических решеток являются:
1. Объемно - центрированная кубическая (ОЦК) (см. рис. 2.2а), атомы располагаются в вершинах куба и в его центре.
2. Гранецентрированная кубическая (ГЦК) (см. рис. 2.2б), атомы располагаются в вершинах куба и по центру каждой из 6 граней.
3. Гексагональная, в основании которой лежит шестиугольник (см. рис. 2.2в):
- простая – атомы располагаются в вершинах ячейки и по центру 2 оснований (углерод в виде графита);
- плотноупакованная (ГПУ) – имеется 3 дополнительных атома в средней плоскости.
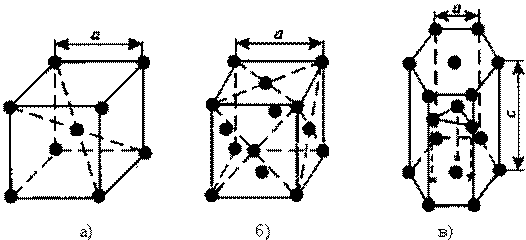
Рисунок 2.2 - Основные типы кристаллических решеток:
а – объемно-центрированная кубическая;
б – гранецентрированная кубическая;
в – гексагональная плотноупакованная
Таблица – Металлы с одним типом решетки
| Тип решетки | Координационное число | Плотность упаковки | Металл |
| ГЦК | 0,74 (74 %) | Ag, Au, Pt, Cu,Al,BP,Ni | |
| ОЦК | 0,68 (68 %) | Na, K,V,Nb, Cr, Mo, W | |
| ГПУ | 0,74 (74 %) | Be,Mg,Zn,Cd, Tiα, Ru |
В зависимости от физической природы сил, действующих между частицами кристалла. Различают четыре типа кристаллов (связей): ионные, атомные, металлические и молекулярные (рис. 2.3).
1. Ионные кристаллы. К ним относят металлы, неметаллы, соли. Структурная единица решетки - ион. Ионы располагаются по закону плотнейшей упаковки. Связь в ионных кристаллах представляет собой взаимодействие противоположно заряженных частиц. Особенности ионной связи: 1. Связь не обладает направленностью. 2. Связь не обладает насыщаемостью. Энергия кристаллической решетки - кол-во энергии которая необходима для того, чтобы разрушить кристалл.
2. Ковалентные (атомные) кристаллы. Структурная единица-атом. Каждый атом образует четыре ковалентные связи со своими соседями. Чаще всего связь неполярная, обладает двумя особенностями: имеет направленность, имеет насыщаемость.
3. Молекулярные кристаллы. Структурная единица-молекула. Различают полярные и неполярные молекулы. Полярность молекулы характеризуется дипольным моментом. Дипольный момент образуется за счет смещения центров положительных и отрицательных зарядов
4. Металлические кристаллы. Тип связи атомов в кристаллических веществах, обладающих металлическими свойствами (металлах, металлидах). Металлический тип связи характеризуется тем, что между решеткой из положительно заряженных ионов и окружающими их свободными валентными электронами возникает электростатическое притяжение.
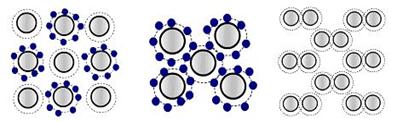

а б в г
Рисунок 2.3 - Типы кристаллов (связей)
а – ионная (NaCl);
б – ковалентная (алмаз);
в – молекулярная (Ван-дер-Ваальсовая);
г - металлическая (1 – атомное ядро; 2 – атомный остов; 3 – обобщенные электроны).
Понятие об изотропии и анизотропии.
Свойства тела зависят от природы атомов, из которых оно состоит, и от силы взаимодействия между этими атомами. В аморфных телах с хаотическим расположением атомов в пространстве расстояния между атомами в различных направлениях равны, следовательно, свойства будут одинаковые, то есть аморфные тела изотропны
В кристаллических телах атомы правильно располагаются в пространстве, причем по разным направлениям расстояния между атомами неодинаковы, что предопределяет существенные различия в силах взаимодействия между ними и, в результате различия в свойствах. Зависимость свойств от направления называется анизотропией
Для обозначения кристаллографических плоскостей (плоскостей, проходящая через узлы решетки) и направлений (прямых, проходящих через узлы решетки) пользуются индексами Миллера. Чтобы установить индексы Миллера, элементарную ячейку вписывают в пространственную систему координат (оси X,Y, Z – кристаллографические оси). За единицу измерения принимается период решетки.
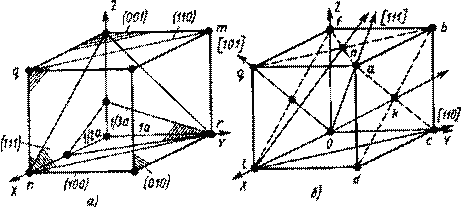
Рисунок 2.4 - Примеры обозначения кристаллографических плоскостей (а) и кристаллографических направлений (б)
Примеры обозначения кристаллографических плоскостей приведены на рисунке 2.4 а.
Индекс по оси показывает, на сколько частей плоскость делит осевую единицу по данной оси. Плоскости, параллельные оси, имеют по ней индекс. Индексы указываются в круглых скобках
Индексы кристаллографических направлений указываются в квадратных скобках [111], рис. 2.4. б. В кубической решетке индексы направления, перпендикулярного плоскости (hkl) имеют те же индексы [hkl].
Аллотропия или полиморфные превращения.
Способность некоторых металлов существовать в различных кристаллических формах в зависимости от внешних условий (давление, температура) называется аллотропией или полиморфизмом. Каждый вид решетки представляет собой аллотропическое видоизменение или модификацию.
Таблица - Металлы с полиморфным превращением
| Металл | Тип решетки | Температура превращения, °С |
| Ca | ГЦК ↔ ГП | |
| Ti | ГП ↔ ОЦК | |
| Fe | ОЦК↔ ГЦК ↔ ОЦК | 911↔ 1392 ↔1539 |
Превращение одной модификации в другую протекает при постоянной температуре и сопровождается тепловым эффектом. Видоизменения элемента обозначается буквами греческого алфавита в виде индекса у основного обозначения металла.
Примером аллотропического видоизменения, обусловленного изменением давления, является углерод: при низких давлениях образуется графит, а при высоких – алмаз.
Используя явление полиморфизма, можно упрочнять и разупрочнять сплавы при помощи термической обработки.
Магнитные превращения.
Некоторые металлы намагничиваются под действием магнитного поля. После удаления магнитного поля они обладают остаточным магнетизмом. Это явление впервые обнаружено на железе и получило название ферромагнетизма. К ферромагнетикам относятся железо, кобальт, никель и некоторые другие металлы.
При нагреве ферромагнитные свойства металла уменьшаются постепенно: вначале слабо, затем резко, и при определенной температуре (точка Кюри) исчезают (точка Кюри для железа – 768°С). Выше этой температуры металлы становятся парамагнетиками. Магнитные превращения не связаны с изменением кристаллической решетки или микроструктуры, они обусловлены изменениями в характере межэлектронного взаимодействия.
Лекция 2. (продолжение)
| Особенности реального строения металлов. Дефекты кристаллического строения Точечные дефекты Линейные дефекты. Типы дислокаций. Границы зерен. |
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 2848; Нарушение авторских прав?; Мы поможем в написании вашей работы!