
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Молекула фтористого водорода
|
|
|
|
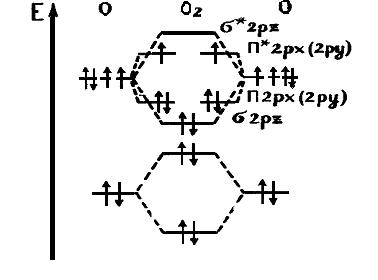
Энергетическая молекулярная диаграмма азота и кислорода
В атоме N электроны внутреннего слоя не принимают участие в образовании химической связи. Восемь орбиталей атома каждого азота комбинируются в восемь молекулярных орбиталей N2. На внешних 2 – s и 2 – р – орбиталях находится 10 электронов, которые вначале заполняют орбитали с наиболее низкой энергией. При этом разрыхляющие орбитали остаются свободными. Электроны 2s - орбиталей заполняют обе орбитали (связующую и разрыхляющую) и не образуют химической связи, это неподеленные электронные пары атома азота.

Вывод: Молекула будет устойчивой только в том случае, если сумма электронов на связывающих орбиталях будет превышать сумму электронов на разрыхляющих.
Молекула кислорода. На внешнем слое 2-х атомов кислорода содержится 12 электронов. 10 располагаются как у молекулы азота. Оставшиеся 2 располагаются на двух 2px и 2рy – π разрыхляющих орбиталях. В соответствии с рисунком мы видим 2 неспаренных электрона, что решает вопрос о парамагнитности молекулы кислорода.
Энергия 1s электрона атома Н выше, чем энергия 2р электрона атома F; энергия 2s- электрона атома F2 еще меньше, поэтому взаимодействие 1s и 2s электронов маловероятно. Следовательно, с 1s орбиталью атома Н будет реагировать 2р орбиталь атома F, а именно рx, та которая ориентирована по линии связывающей центры атомов. В результате взаимодействия могут образовываться 2σ МО связывающая и разрыхляющая. Связывающая орбиталь обладает энергией ниже, чем энергией р-орбиталей. АО F2 2s, 2py, 2pz образуют МО с энергией как у исходного атома. Эти МО называются несвязывающими. Электроны находящиеся на них не принимают участие в образовании связи.

Какое же значение имеет метод МО?
Данный метод является мощным средством исследования строения молекул. В настоящее время выполнены расчеты множества формул, которые включают в себя десятки атомов, что позволяет прогнозировать биологическую активность вещества. Кроме прогнозирования свойств молекул данный метод позволяет моделировать химические реакции.
ЛЕКЦИЯ № 5
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 542; Нарушение авторских прав?; Мы поможем в написании вашей работы!