
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Составление окислительно-восстановительных реакций ионно-электронным способом
|
|
|
|
Этот метод основан на составлении ионных уравнений для процессов окисления и процесса восстановления с последующим суммированием их в общее уравнение. При использовании этого метода не определяют степени окисления, а рaссматривают ионы или молекулы окислителя. Восстановителя и продуктов реакции в том виде, как они существуют в растворе. При этом следует руководствоваться общими правилами составления ионных уравнений реакций, т.е. записывать сильные электролиты в ионном виде, а слабые электролиты, газы – в молекулярном. В растворе нет иона N+5, а есть NO3‾; нет иона Mn+7, а есть MnO4‾.
Как составляются уравнения реакции с помощью этого метода:
1. составить молекулярное уравнение;
2. составить краткое ионное уравнение реакции;
3. найти атом, молекулу, ион – окислитель; атом, молекулу, ион – восстановитель;
4. записать частные уравнения окисления и восстановления.
Если реакция протекает в кислой среде, то в растворе есть ионы Н+ и Н2О – молекулы. Если реакция протекает в щелочной среде, то в растворе присутствуют ОН‾ - группа и Н2О;
5. суммируем оба уравнения, для электронного баланса помножая на коэффициенты;
6. найденные коэффициенты переносим в молекулярное уравнение.
Рассмотрим окислительно-восстановительный процесс на примере взаимодействия перманганата калия (KMnO4) с нитритом калия в кислой среде.
В перманганате калия марганец (Mn) находится в высшей степени окисления и может быть только окислителем, т.е. принимать  .
.
Азот в NO2‾ имеет степень окисления (+5) и может отдавать  , т.е. быть восстановителем.
, т.е. быть восстановителем.
Таким образом:
1. KNO2 + KMnO4 + H2SO4 → KNO3 + MnSO4 + H2O + (K2SO4)
2. 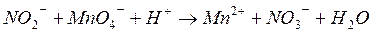
3. ион-окислитель MnO4‾
ион-восстановитель NO2‾
4. Процесс восстановления: MnO4‾ → Mn2+
Окислитель (ион MnO4‾) теряет кислород. В кислой среде кислород окислителя соединяется с ионами H+, образуя воду. Чтобы взять 4 атома кислорода в ионе MnO4‾, следует добавить 8 ионов H+, при этом образуется 4 молекулы воды.
Считаем суммарный заряд правой и левой части уравнения:
 MnO4‾ + 8 H+ → Mn2+ + 4 H2O0
MnO4‾ + 8 H+ → Mn2+ + 4 H2O0
Следовательно окислитель должен принять 5  .
.
MnO4‾ + 8 H+ + 5  → Mn2+ + 4 H2O0
→ Mn2+ + 4 H2O0
Процесс окисления: NO2‾ → NO3‾
Избыток кислорода в NO3‾ может быть получен, если мы прибавим в левой части уравнения H2O.
Считаем суммарный заряд правой и левой части уравнения:
NO2‾ + H2O0 → NO3‾ + 2 H+
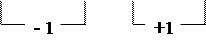
Следовательно ион NO2‾ отдает 2  .
.
NO2‾ + H2O0 – 2  → NO3‾ + 2 H+
→ NO3‾ + 2 H+
5. Суммируем два уравнения, для уравнивания числа принятых и отданных электронов, умножаем первое уравнение на 2, второе уравнение на 5.
MnO4‾ + 8 H+ + 5  → Mn2+ + 4 H2O0
→ Mn2+ + 4 H2O0
 NO2‾ + H2O0 – 2
NO2‾ + H2O0 – 2  → NO3‾ + 2 H+
→ NO3‾ + 2 H+
2 MnO4‾ + 16 H+ + 5 NO2‾ + 5 H2O → 2 Mn2+ + 8 H2O + 5 NO3‾ + 10 H+
Получаем:
2 MnO4‾ + 6 H+ + 5 NO2‾ → 2 Mn2+ + 3 H2O + 5 NO3‾
6. Переносим в молекулярное уравнение:
5 KNO2 + 2 KMnO4 + 3 H2SO4 → 5 KNO3 + 2 MnSO4 + 3 H2O + (K2SO4)
(досчитаем количество ионов не изменяющих степень окисления).
Следует запомнить:
Ø Если реакция протекает в кислой среде, то можно оперировать ионами Н+ и молекулами Н2О. Ионы Н+ записываются в той части уравнения, где есть избыток кислорода; молекулы Н2О записываем, где кислорода нет или недостаток. Количество атомов водорода берется в 2 раза больше, чем количество избыточных атомов кислорода.
Ø Если реакция протекает в нейтральной среде, следует оперировать только молекулами Н2О. Причем недостаток кислорода восстановитель восполняет из молекул Н2О за счет ОН‾ ионов. На каждый недостающий атом кислорода расходуется 1 молекула Н2О, в растворе накапливается ион Н+. Избыток кислорода в окислителе связывается молекулами Н2О за счет Н+ - ионов, причем на каждый избыточный атом кислорода расходуется 1 молекула Н2О в растворе накапливаются ОН- ионы. рН среды по окончанию реакции определяется соотношением полученных Н+ и ОН‾ ионов.
Рассмотрим пример:
1. KMnO4 + KNO2 + H2O → MnO2 + KNO3 + KOH
2. MnO4‾ + NO2‾ + H2O → MnO2 + NO3‾ + OH ‾
3. Процесс восстановления: MnO4‾ → MnO2
MnO4‾ + 2 H2O0 → MnO20 + 4 OH‾

MnO4‾ + 2 H2O0 + 3  → MnO20 + 4 OH‾
→ MnO20 + 4 OH‾
Процесс окисления: NO2‾ → NO3‾
NO2‾ + H2O0 → NO3‾ + 2 H+
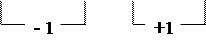
NO2‾ + H2O0 – 2  → NO3‾ + 2 H+
→ NO3‾ + 2 H+
4. Суммируем два уравнения:

 MnO4‾ + 2 H2O0 + 3
MnO4‾ + 2 H2O0 + 3  → MnO20 + 4 OH‾ 2 процесс восстановления
→ MnO20 + 4 OH‾ 2 процесс восстановления
 NO2‾ + H2O0 – 2
NO2‾ + H2O0 – 2  → NO3‾ + 2 H+ 3 процесс окисления
→ NO3‾ + 2 H+ 3 процесс окисления
 2 MnO4‾ + 4 H2O + 3 NO2‾ + 3 H2O → 2 MnO2 + 3 NO3‾ + 8 OH‾ + 6 H+
2 MnO4‾ + 4 H2O + 3 NO2‾ + 3 H2O → 2 MnO2 + 3 NO3‾ + 8 OH‾ + 6 H+
6 H2O + 2 OH ‾
5. Переносим в молекулярное уравнение:
2 KMnO4 + 3 KNO2 + H2O → 2 MnO2 + 3 KNO3 + 2 KOH
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 1387; Нарушение авторских прав?; Мы поможем в написании вашей работы!