
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методические указания
|
|
|
|
Микроорганизмов
Методы исследования и культивирования
Лабораторная работа №1
Характеристика бактериофагов
Цель работы:
1. Повторение и закрепление навыков работы с микроскопом.
2. Совершенствование техники приготовления препаратов и микроскопирования.
3. Знакомство с назначением, составом и техникой приготовления питательных сред,
4. Изучение методов культивирования микроорганизмов.
Объект изучения общей микробиологии - многочисленные микроскопические организмы, играющие важную роль в природе и жизнедеятельности человека. Их отличает огромное разнообразие форм, а общим свойством является малый размер (0,1 – 100 мкм). Поэтому для изучения микроорганизмов на практике используют специальные методы и приемы: микроскопирование, выращивание в пробирках, колбах, чашках Петри на жидких и плотных средах, выделение чистых культур, приготовление препаратов живых и инактивированных клеток и др.
При изучении морфологии микроорганизмов применяют различные виды микроскопирования, так как невооруженный глаз человека с расстояния около 250 мм при нормальной остроте зрения способен различить детали размером не менее 0,15 мм. Для наблюдения микроорганизмов в лабораторной практике используют в основном биологические микроскопы моделей МБР «Биолан», «Laboval - 2», МБИ - 1 и др.
Устройство и правила работы с микроскопом подробно рассмотрены в курсе «Общая биология» (см. лабораторную работу №1).
Для полного использования оптических возможностей современных биологических микроскопов необходимо устанавливать освещение препарата в соответствии с принципом Келера (при установке освещения апертуры коллектора осветителя, конденсора и объектива должны быть равны между собой). В зависимости от типа осветителя в практике используют разные приемы установки освещения поля исследования. Для осветителя марки 0И-31У1.1 порядок установки освещения следующий:
1. Конденсор микроскопа поднимают в верхнее положение и полностью закрывают его диафрагму.
2. Увеличить яркость лампы реостатом (блок питания).
3. Проверить симметричность изображения на нижней стороне ирисовой диафрагмы конденсора.
4. Установить объектив х8.
5. Уменьшить яркость лампы реостатом.
6. На предметный столик микроскопа помещают препарат
7. Открыть диафрагму конденсора на 2/3.
8. Сфокусировать микрообъект с помощью механизма наводки (микровинтом). Для этого расположить объектив на расстоянии 1см от препарата и, глядя в окуляр медленно опустить предметный столик, находя изображение.
9. Закрыть диафрагму. В поле зрения видно нерезкое изображение краев диафрагмы светового поля.
10.Перемещением конденсора добиваются резкого изображения диафрагмы осветителя в поле зрения микроскопа. Отцентрировать светлое пятно с помощью центровочных винтов.
11.Открыть диафрагму светлого поля, чтобы края светлого пятна чуть заходили на поле зрения (на 2/3 диаметра).
При работе с объективом малого увеличения поле зрения микроскопа будет освещено не полностью ввиду несоответствия апертуры конденсора и объектива.
При использовании сильных объективов с числовым значением апертуры больше единицы (1) настройка освещения согласно принципу Келера обеспечивает максимальную разрешающую способность оптики микроскопа.
При работе с объективами масляной иммерсии (А = 1,25 - 1,3) рекомендуется на препарат наносить каплю иммерсионного масла (n = 1,515), а линзу конденсора иммергировать водой (n = 1,333).
Исследование всякого объекта следует начинать с объектива сухой системы. дающего малое увеличение. При этом в поле зрения попадает большой участок препарата, что позволяет выбрать для изучения более интересное место. Ирисовая диафрагма при работе со слабыми объективами закрывают почти полностью, а степень накала нити лампочки уменьшают трансформатором. Фокусировка объекта ведется макрометрическим винтом
Микроскоп через блок питания подключают к электрической сети. С помощью револьвера закрепляют объектив с увеличением х8. Легкий упор и звук щелчка пружины револьвера свидетельствуют о том, что объектив установлен по оптической оси. Макрометрическим винтом опускают объектив на расстояние 0,5 - 1,0 см от предметного столика.
Правила работы с сухими и иммерсионными объективами подробно рассмотрены в курсе «Общая биология» (см. лабораторную работу №1). При смене объективов не следует забывать, что разрешающая способность микроскопа зависит от соотношения апертуры объектива и конденсора. Числовая апертура объектива с увеличением х40 составляет 0,65, неиммергированного конденсора - 0,95. Привести их в соответствие практически можно следующим приемом: сфокусировав препарат с объективом, следует вынуть окуляр и, глядя в тубус, прикрывать ирисовую диафрагму конденсора до тех пор, пока ее края не станут видны у границы равномерно освещенной задней линзы объектива. В этот момент числовые апертуры конденсора и объектива будут примерно равны.
По окончании работы с иммерсионным объективом поднимают тубус, снимают препарат и осторожно протирают фронтальную линзу объектива сначала сухой мягкой хлопчатобумажной салфеткой, затем той же салфеткой, но слегка смоченной чистым бензином. Оставлять масло на поверхности линзы нельзя, так как оно способствует оседанию пыли и может привести со временем к повреждению оптики микроскопа. Препарат освобождают от масла сначала кусочком фильтровальной бумаги, затем обрабатывают стекло бензином или ксилолом.
Оптическая система микроскопа, как и его механическая часть, должна быть в полной исправности. Если микроскоп хранится в деревянном футляре, то линзы его через несколько недель покрываются пылью, поэтому в дополнение к футляру следует использовать полиэтиленовый чехол. Таким же чехлом должны быть накрыты и микроскопы, стоящие на столах.
Загрязнение оптической системы вызывает нечеткость изображения. Полную чистку микроскопа нужно производить примерно раз в год и обязательно специалистом - оптиком. При работе с иммерсией нельзя пользоваться смесью масел разных марок, так как они имеют разный коэффициент преломления, что вызовет искажение изображения.

|
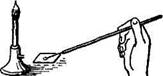
| Рис. 1.1. Бактериологическая петля: 1,2 - неправильно сделанные; 3 – правильно сделана. |
Препараты для микроскопических исследований (мазки) готовят на специальных предметных стеклах, толщина которых не должна превышать 1,2 мм. Стекла заблаговременно тщательно очищают.
Для приготовления мазка на поверхность предметного стекла наносят стерильной бактериологической петлей (рис. 1.1.) или пастеровской пипеткой каплю исследуемого материала и равномерно тонким слоем размазывают на площади 1,5 - 2,0 см2.
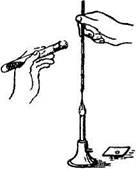
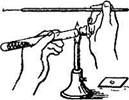
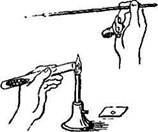
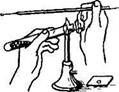
При приготовлении мазков из плотных сред (субстратов) предварительно на предметное стекло помещают каплю стерильной воды, затем бактериологической петлей вносят в нее исследуемый материал и размазывают тонким слоем до получения мазка. Бактериологическую петлю до и после использования прокаливают на пламени горелки (рис. 1.2(8)). Пастеровскими пипетками делают мазки из жидких субстратов, для чего над пламенем горелки отламывают запаянный конец, набирают материал и наносят каплю материала на предметное стекло. Мазок высушивают при комнатной температуре и фиксируют, чтобы он не смывался при обработке красками и водой, а также чтобы убить микробы для лучшего восприятия ими окраски.
Приготовление препаратов живых клеток. В зависимости от объекта и цели исследования живые клетки микроорганизмов наблюдают на препаратах «раздавленная капля» или «висячая капля».
| 
| 
| 
|

| 
| 
| 
|
| Рис. 1.2. Последовательность работ при приготовлении мазка |
Техника приготовления и назначение препарата «раздавленная капля» подробно рассмотрены в курсе «Общая биология» (см. лабораторную работу №2). Приготовленный препарат сразу же исследуют, так как жидкость высыхает и микроскопирование затрудняется.
Препарата «висячая капля». На покровное стекло наносят небольшую каплю суспензии микроорганизмов, переворачивают каплей вниз и помещают на специальное предметное стекло с углублением (лункой) в центре. Капля должна свободно висеть, не касаясь краев и дна лунки. Если предстоят многодневные наблюдения, то края лунки смазывают вазелином и капля оказывается герметически заключенной во влажной камере. Препарат висячая капля используют для выявления подвижности микроорганизмов, изучения способов размножения, наблюдение за прорастанием спор.
Техника приготовления и назначение препаратов фиксированных клеток подробно рассмотрены в курсе «Общая биология» (см. лабораторную работу №2)
Фиксированными считают клетки микроорганизмов, в которых прерваны жизненные процессы, но полностью сохранена тонкая структура. Окрашенные фиксированные клетки и детали их строения резче выделяются на фоне препарата, что облегчает изучение формы, размеров, внутренних элементов (ядра, оболочки, спор, включений), упрощает подсчет количества клеток. Фиксированные препараты обычно рассматривают с иммерсией.
Окрашивание мазка. Существует позитивный и негативный способы окраски. При позитивном способе окраски окрашиваются клетки микроорганизмов. При негативном контрастировании краситель заполняет пространство, окружающее клетки, в результате чего микроорганизмы, в которые краситель не проникает, выглядят как светлые частицы на равномерно окрашенном поле. Для простого позитивного окрашивания клеток микроорганизмов чаще всего пользуются анилиновыми красителями: фуксином, генцианвиолетом, метиленовым синим. Фиксированный препарат помещают на параллельные стеклянные рейки, лежащие на стенках кюветы, и наносят на стекло из пипетки раствор выбранного красителя. Сроки окрашивания указанными красителями колеблются от 1 до 3 мин. В этот период краситель должен покрывать весь мазок. Затем его смывают легкой струёй воды. При этом со стекла смоется только лишний краситель, не адсорбированный микроорганизмами. Потом препарат высушивают, осторожно промокая его фильтровальной бумагой.
Для негативного окрашивания чаще всего пользуются жидкой тушью или конго красным. Окрашивание негативными красителями можно вести двумя путями: либо раствор наносят на сухой мазок, дают ему высохнуть и сухой препарат рассматривают с иммерсией, либо каплю исследуемой суспензии бактерий смешивают с красителем непосредственно на предметном стекле, покрывают ее покровным стеклом и изучают с сухой системой.
Культивирование (выращивание) микроорганизмов широко используется в лабораторных и производственных условиях для их выделения, накопления и сохранения. Этот метод применяется при качественном анализе микрофлоры различных объектов для изучения биологических свойств микроорганизмов и их идентификации, при количественном анализе - для подсчета жизнеспособных особей, в производственных условиях - для накопления полезных микроорганизмов и продуктов их жизнедеятельности.
Для культивирования микроорганизмов используют специальные питательные среды, которые должны содержать все вещества, необходимые для роста и размножения данного микроба, в легко усвояемой форме. Они должны быть изото-ничными, иметь оптимальную влажность, вязкость, рН, окислительно-восстановительный потенциал; быть стерильными.
Все микроорганизмы нуждаются в так называемых органогенных элементах: углероде, кислороде, азоте, водороде. В значительных количествах они потребляют фосфор и серу. Кроме того, они нуждаются в так называемых макроэлементах (Fe, Са, К, Mg, Mn), микроэлементах (Си, Со, В, Мо) и факторах роста (витамины, пури-новне и пиримидиновне основания, незаменимые аминокислоты). По отношению к источникам углеродного питания их делят на автотрофов и гетеротрофов.
Автотрофные микроорганизмы удовлетворяют свои потребности в углероде за счет углекислоты атмосферы. К ним относятся многие виды почвенных бактерий (например, нитрифицирующие бактерии, серобактерии, железобактерии и др.). Они получают необходимую энергию за счет окисления простейших минеральных веществ (например, аммиака, сероводорода и др.). Этот процесс называется хемосинтезом.
Для значительной группы микроорганизмов лучшим источником углерода являются органические соединения. Такие микроорганизмы называются гетеротрофами. В состав этой группы входят сапрофиты, или метатрофы (возбудители брожений, гнилостные микробы), питающиеся мертвыми остатками животных и растительных тканей, и паразиты, или паратрофы, питающиеся веществами живого организма (возбудители различных инфекций у животных и растений). Среди паратрофов имеются строгие паразиты, живущие только за счет живой клетки (вирусы, риккетсии).
Необходимую энергию гетеротрофные микроорганизмы получают за счет окисления или брожения органических соединений. Источником углерода для них могут быть самые различные органические соединения, начиная от моносахаров до сложных углеводородов, белков и жиров.
Между хемоавтотрофами и гетеротрофами имеются промежуточные группы микроорганизмов, так называемые факультативные авто- и гетеротрофы. Кроме того, имеются микроорганизмы, способные в определенных условиях переходить с одного типа питания на другой. Даже паратрофные микроорганизмы (за исключением вирусов и риккетсии) могут хорошо усваивать различные органические соединения из мертвых субстратов. Это делает возможным их культивирование на искусственных питательных средах и в достаточной степени длительное существование на положении сапрофитов в почве, воде и других субстратах.
Универсальных сред, одинаково пригодных для роста всех без исключения микроорганизмов, не существует. В зависимости от особенностей обменных процессов микроорганизмов и задач исследования составы питательных сред значительно отличаются.
По назначению различают элективные и дифференциально-диагностические (индикаторные) среды.
Элективные среды обеспечивают преимущественное развитие одного вида или группы микроорганизмов и менее пригодны (или совсем непригодны) для развития других.
Дифференциально-диагностические (индикаторные) среды позволяют достаточно быстро отличить одни виды микроорганизмов от других. Состав этих сред подбирают с таким расчетом, чтобы он позволил четко выявить наиболее характерные свойства определенного вида
По физическому состоянию различают жидкие, плотные и сыпучие среды. Жидкие среды применяют для выяснения физиолого-биохимических особенностей микроорганизмов, для накопления биомассы или продуктов метаболизма, а также поддержания и хранения многих микроорганизмов, плохо развивающихся на плотных средах. Сыпучие среды применяют в промышленной микробиологии. К ним относятся, например, разваренное пшено, отруби, кварцевый песок, пропитанные питательным раствором. Плотные среды используют для выделения чистых культур (получение изолированных колоний), диагностических целей (установление морфологии колоний, особенностей роста на скошенном агаре и др.), для хранения культур, количественного учета микроорганизмов, определения их антагонистических свойств и в ряде других случаев.
Уплотнение сред осуществляют с помощью агар-агара, желатины и кремнекислого геля (силикагеля). Агар-агар - полисахарид, выделенный из морских водорослей, обладает рядом полезных свойств: образует в воде гели, плавящиеся при 100° и затвердевающие при 45°, не расщепляется под влиянием большинства видов микроорганизмов. Плотные среды готовят с добавлением агар-агара от 0,15 до 3%.
Менее широко используется желатина - белок, получаемый при вываривании костей и хрящей животных. Желатину добавляют к жидким средам в количестве 10-15%. Образуемый желатиновый гель плавится при 23-26° С.
При специальных исследованиях используется кремнекислый гель (силикагель) - вещество неорганической природы и его используют как твердую основу для синтетических сред.
По составу различают натуральные, полусинтетические и синтетические среды. На натуральных средах хорошо развиваются самые разнообразные микроорганизмы. Однако состав этих сред очень сложен, непостоянен, что влияет на рост микроорганизмов и не позволяет изучать их биохимию и физиологию. Натуральные среды используют главным образом для поддержания культур микроорганизмов, накопления их биомассы и для диагностических целей.
Примеры натуральных сред:
1. Мясо-пептоный бульон (МПБ) - экстракт из мяса, содержит продукты неполного распада белка - пептоны, в которых живется органический углерод, органический азот, фосфорсодержащие, серосодержащие и основные минеральные вещества в виде растворимых соединений. Применяется для выращивания многих видов бактерий.
2. Пивное сусло - экстракт из проросших зерен ячменя (солода), содержит в качестве источника углерода сахар, азотистые вещества, зольные элементы, витамины группы В. Является хорошей средой для развития многих микроорганизмов (дрожжей, плесневых грибов).
3. Хорошими натуральными средами являются картофель, молоко, отвары из плодов и овощей, а для промышленности - меласса, щелока, гидролизаты (отходы пищевой промышленности).
Полусинтетические среды в своем составе наряду с соединениями известной химической природы содержат вещества неопределенного состава.
К полусинтетическим средам относят мясо-пептонный бульон с глюкозой и фосфорнокислым калием, картофельную среду с глюкозой и пептоном, а также среды известного состава с добавкой различных факторов роста (гидролизата казеина, дрожжевого автолизата, кукурузного экстракта и т. д.).
Синтетические среды являются результатом более точного изучения потребностей микроорганизмов в питательных веществах. Преимущества синтетических сред заключаются в том, что они точно воспроизводимы. Это позволяет использовать их для исследования обмена веществ микроорганизмов. Они находят все большее применение в точных экспериментальных исследованиях и в промышленности.
Примеры синтетических сред:
Среда для культивирования бактерий (в г на л водопроводной воды): глюкоза -20,0; NH4 - 1,0; К2НРО4 - 0,5; MgSO4·7H2O - 0,5; NaCl - 0,5; рН среды - 7,0.
Среда для культивирования актиномицетов (в г на л водопроводной вода): крахмал - 20,0; KNO3 - 1,0; К2НРО4 - 0,5; MgSO4·7H2O - 0,5; NaCl - 0,5; агар-агар - 20,0; рН среды - 7,2. - 7,3.
Среда для культивирования углеводородокисляющих дрожжей (в г на л водопроводной воды): парафин - 1,0; (NH4)SO4 - 3,0; К2НРО4 - 1,0; MgSO4·7H2O - 0,5; Ca(NO)3 - 0,5; NaCl - 0,5; рН среды - 6,0.
Среды Чапека для культивирования грибов следующий: глюкоза - 30 г; NaNO3 -2 г; К2НРО4 - 1 г; MgSO4·7H2O - 0,5 г; КС1 - 0,5 г; Fe2(SO4)3 - 0,01 г; вода - 1000 мл.
В особую группу выделяют селективные среды, на которых ведется селекция микробов против какого-то признака, например среда с примесью пенициллина селективна для пенициллиноустойчивых бактерий.
В настоящее время большое количество питательных сред готовят по специальным рецептам на фабриках и выпускают в виде сухих порошков или жидких концентратов.
Рост микробов, их морфология и физиологические свойства проявляются только на питательной среде, имеющей оптимальный рН для данного вида микроба. Для большинства бактерий оптимум рН 7,0—8,5, т. е. они развиваются в слабощелочной среде, в то время как плесневые грибы и дрожжи развиваются в кислой среде при рН 6,8—4,5.
Определение в среде концентрации водородных ионов осуществляют либо грубым методом - с помощью лакмусовой бумаги, либо более точно на потенциометрах.
При культивировании микроорганизмов требуется соблюдать асептические условия, а именно: использовать стерильные питательные среды, посуду, инструменты, материалы.
Стерилизация, или обеспложивание, — это полное уничтожение микроорганизмов, их спор и всего живого в средах и предметах лабораторного обихода.
Существуют различные способы стерилизации:
• термическая стерилизация - кипячение, прокаливанием в пламени, горячим воздухом, насыщенным паром под давлением (автоклавирование), дробным нагреванием текучим паром (тиндализация);
• холодная стерилизация - фильтрованием, обработка ультрафиолетовыми лучами, ультразвуком или химическими веществами (антисептиками).
Выбор способа стерилизации определяется свойствами стерилизуемого объекта и целью исследования.
Химическая стерилизация основана на губительном действии химических веществ (хлороформ, фенол, формалин, хлорная известь, хлорамин, растворы йода, сулемы и др.).
Обработка химическими вещества объектов внешней среды, рабочего места, помещений, рабочей одежды, рук, называют дезинфекцией.
Методы стерилизации высокой температурой — самые надежные и наиболее распространенные физические методы.
Прокаливание на пламени (фламбирование) используется для обработки мелких инструментов - бактериологических петель, игл, пинцетов, предметных стекол.
Кипячение — проводится в специальных стерилизаторах (рис. 1.3) в течение 10 - 15 мин в воде с добавление 1 - 2% соды, что значительно повышает стерилизующее действие и устраняет жесткость воды и предохраняет металлические предметы от ржавчины. Этот метод не обеспечивает полной стерилизации, так как споры некоторых бацилл и клостридий выдерживают кипячение в течение нескольких часов.
Стерилизация сухим жаром или горячим воздухом проводится в специальных печах Пастера или сухожаровых шкафах (рис. 1.4), где обрабатывают марлю, пробирки, пастеровские и градуированные пипетки колбы, чашки Петри и другую стеклянную посуду. Перед стерилизацией посуду хорошо моют, высушивают, закрывают пробирки и колбы ватными пробками, пипетки завертывают в бумагу. Стерилизация проводится при 160 - 170°С в течение 1,5 ч с момента достижения этой температуры. Стерилизованную посуду из печи Пастера следует извлекать после ее охлаждения.
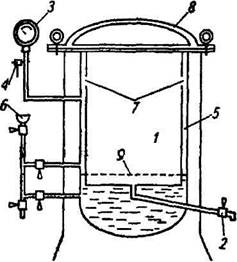
Стерилизация паром под давлением — самый эффективный способ стерилизации, даже однократная стерилизация паром под давлением уничтожает не только вегетативные, но и споровые формы бактерий. Стерилизацию паром под давлением проводят в специальных аппаратах — автоклавах (рис. 1.5). Автоклав представляет собой массивный двухстенный котел, окруженный снаружи металлическим кожухом и снабженный массивной откидывающейся крышкой, которая плотно привинчивается к котлу откидными болтами. Между стенками котла имеется свободное пространство, в которое заливается вода, которая при нагревании тэнами до кипячения превращается в пар и через отверстия поступает во внутреннюю стерилизационную камеру автоклава.
Работа с автоклавом сопряжена с некоторыми опасностями и должна проводиться при соблюдении определенных правил подготовленными и проинструктированными сотрудниками.
Стерилизация в автоклаве проводится обычно при 1 ати (сверх нормального атмосферного) или при 1,5 ати. В отдельных случаях при сильном обсемененности материала устойчивыми к температуре формами микроорганизмов стерилизация проводится при повышенном давлении, доходящем до 2 ати. Температуры, соответствующие различным режимам работы автоклава приведены в таблице 1.1. Продолжительность стерилизации колеблется от 30 мин до 1 — 1,5 ч. Стерилизуют в автоклаве питательные среды, лабораторную посуду, перевязочный материал, халаты, хирургические инструменты, отработанные культуры и т. д.

| 
|
| Рис 1.3. Стерилизатор | |

| Рис. 1.5. Автоклав вертикальный. 1 - стерилизационная камера, 2 - кран для выхода воздуха, 3 - манометр, 4 -предохранительный клапан, 5 - водопаровая камера, 6 - воронка для заполнения автоклава водой, 7 - отверстия для поступления пара в стерилизационную камеру, 8 - крышка автоклава, 9 - подставка для размещения стерилизуемых материалов. |
| Рис. 1.4. Печь Пастера |
Правила работы с автоклавом
Стерилизация в автоклаве производится под повышенным давлением, поэтому работа с ним требует осторожности. Исправность автоклава проверяют работники котлонадзора, которые устанавливают следующий срок проверки.
Промышленность выпускает разные системы автоклавов, но все они имеют общие принципы устройства, и правила работы с ними однотипны. Во внутренний котел автоклава (стерилизационную камеру) помещают материал, подлежащий стерилизации. В водопаровую камеру наливают воду с таким расчетом, чтобы уровень ее в водомерной трубке был между верхней (максимальной) и нижней (минимальной) чертой.
Крышку автоклава привинчивают болтами к корпусу. Завинчивают болты попарно, крест-накрест, чтобы избежать перекоса крышки, который может возникнуть при завинчивании болтов по кругу. Открывают краны и включают источник обогрева. Когда пар из выпускного крана начинает выходить непрерывной струей, кран закрывают и наблюдают за постепенным повышением давления в котле по манометру.
Отсчет времени стерилизации начинают с того момента, когда в автоклаве установится заданное давление. Между показаниями манометра и температурой кипения воды имеется зависимость, приведённая в таблице 1.1.
Таблица 1.1
| Показания манометра, атм | Температура кипения воды, С |
| 0,5 | |
| 1,0 | |
| 1,5 | |
| 2,0 | 134,18 |
Нулевым давлением считают нормальное атмосферное давление (760 мм рт. ст.). Время от времени эти соотношения следует проверять. Нарушение их указывает на неисправность автоклава и на необходимость его ремонта.
После окончания заданного срока стерилизации источник нагрева выключают и дают автоклаву остыть до падения стрелки манометра на нулевое деление. Только после этого постепенно открывают выпускной клапан. При быстром выпускании пара могут быть вырваны ватные пробки из стерилизуемой посуды. После полного выхода пара отвинчивают болты крышки (снова крест-накрест) и открывают ее, ориентируя крышку на себя для защиты от выходящего пара.
Если во время стерилизации давление начинает подниматься выше заданного уровня, его регулируют, уменьшая нагрев или выпуская часть пара через предохранительный клапан. Последний должен быть отрегулирован так, чтобы при повышении давления излишек пара выходил автоматически.
Стерилизация текучим паром применяется в тех случаях, когда стерилизуемый материал изменяется при температуре выше 100° С. Текучим паром стерилизуют питательные среды, содержащие белки, углеводы, молоко, картофель и др. Для стерилизации текучим паром используют автоклав с незакрепленной крышкой и открытым паровыпускным краном или специальный аппарат Коха. Этот метод вызывает гибель только вегетативных форм микробов, а споровые сохраняют свою жизнеспособность. Для уничтожения споровых форм прибегают к повторной стерилизации через сутки, повторяя ее три раза. Это так называемая дробная стерилизация.
Тиндализацня — разновидность дробной стерилизации. Она проводится в аппаратах Коха или в специальных водяных банях с целью уничтожения микроорганизмов в веществах, легко разрушающихся и денатурирующих при температуре выше 60° С (нативные белки сыворотки крови и яиц, витамины и т. д.) в течение 1 ч с 5 - 6-кратным повторением через каждые 24 ч. В интервалах между прогреваниями материал выдерживается при комнатной температуре. За это время споровые формы микробов прорастают и превращаются в вегетативные, которые погибают при повторных прогревах.
Пастеризация _ - однократное прогревание материала в течение 30 мин при температуре 65—70°С или 5—10 мин при температуре 75—80° С. После прогревания материал быстро охлаждают до 10° С и сохраняют при такой температуре. Этот метод направлен на уничтожение только вегетативных форм, преимущественно патогенных, микробов. Споровые же формы и многие сапрофитные микроорганизмы сохраняются. Применяется этот метод для обеспложивания молока, пива, вин и других продуктов. При пастеризации полностью сохраняются витамины и вкусовые качества продуктов. Пастеризованные продукты длительному хранению не подлежат.
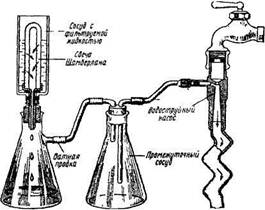
Стерилизация фильтрованием применяется для освобождения от микробов различных жидкостей (питательные среды и др.), которые нельзя подвергать действию высокой температуры. Этим методом механически отделяют бактерии от экзотоксинов, фагов и фильтрующихся форм микробов. Для этого применяют мелкопористые свечи Беркефельда, изготовленные из инфузорной земли, фильтры Шамбер-лана (рис. 1.6), изготовленные из каолина, песка и кварца, и пластинчатые асбестовые фильтры Зейтца.
Фильтры Беркефельда и Шамберлана представляют собой небольшие полые цилиндры — свечи с определенным диаметром пор, обозначаемых номерами. Фильтрование ведется под давлением или в вакууме. Для регенерации свечей их кипятят в водопроводной воде, а затем прокаливают в муфельной печи.
|
| Рис 1.6. Фильтровальный прибор со свечой Шамберлана |
Для того чтобы получить чистую культуру, т.е. организм определенного рода, вида и штамма, без посторонних примесей других микробов, все среды, посуду, пробки стерилизуют, чтобы убить находящиеся в них микробы. Только после этого производится посев и выращивание необходимой культуры.
В зависимости от задач исследования, вида питательной среды и способа ее разливки в лабораторной посуде применяются различные методы посева исследуемого материала. При посеве культуры необходимо соблюдать стерильность, т. е. предотвращать возможность загрязнения исследуемого материала и питательных сред посторонними микроорганизмами.
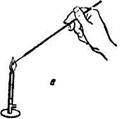
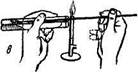
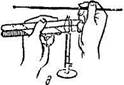
Посев культуры на питательные среды в пробирках. Техника посева по этапам показана на рис. 1.7:
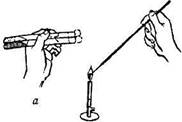
а) пробирки с культурой и стерильной питательной средой кладут на два пальца левой руки в наклонном положении к работающему; пробирки придерживают большим пальцем так, чтобы все манипуляции осуществлялись под контролем глаза; в правую руку, как писчее перо, берут бактериологическую петлю и прокаливают ее в пламени горелки;
б) не выпуская петли, вынимают правой рукой пробки одновременно из обеих пробирок, зажав их между мизинцем и ладонью;
в) стерильную петлю вводят в пробирку с культурой и отбирают материал;
г) производят посев культуры: при посеве на скошенный агар петлю осторожно вводят в пробирку, не доходя до границы конденсационной воды, и зигзагообразными движениями распределяют материал на поверхности агара снизу вверх; посев в агаровый столбик производят путем прокола среды до дна пробирки; при посеве на жидкие среды материал, взятый петлей, наносят на стенку пробирки у верхнего уровня среды и, слегка встряхивают пробирку смывают его средой;
д) после пересева культуры концы пробирок проносят сквозь пламя горелки для стерилизации (фламбируют), обжигают ватные пробки, быстро закрываю пробирки, и прожигают петлю (е).
Посев суспензии микроорганизмов можно производить также с помощью пипетки. С этой целью стерильные пипетки, опускают в емкость с культурой (пробирка, колба), насасывают определенное количество материала, зажимают отверстие пипетки указательным пальцем той же руки и переносят взвесь в питательную среду, выдувая ее из пипетки. Пипетку опускают в сосуд с дезинфицирующим раствором.
| 
| 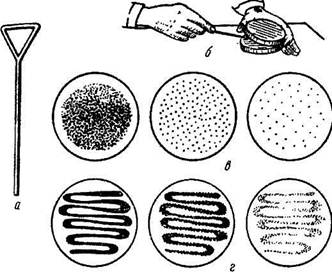 Рис.1.8. Посев микроорганизмов на поверхность плотной среды в чашках Петри:
а — шпатель Дригальского;
б — положение чашки и руки при посеве шпателем;
в — рост микроорганизмов после посева шпателем;
г - рост микроорганизмов после посева петлей
Рис.1.8. Посев микроорганизмов на поверхность плотной среды в чашках Петри:
а — шпатель Дригальского;
б — положение чашки и руки при посеве шпателем;
в — рост микроорганизмов после посева шпателем;
г - рост микроорганизмов после посева петлей
|

| 
| |
| 
| |
| Рис.1.7. Пересев культуры микроорганизмов в пробирки со средой: а, е — стерилизация петли, б — стерилизация краев пробирки; в, г — взятие и посев материала; д — закрытие пробирок пробками |
Посев на плотные среды в чашках Петри осуществляют различными методами в зависимости от необходимости вырастить микроорганизмы в толще среды или на ее поверхности:
а) для глубинного посева (в толще среды используют обычно мерные количества плотной сред заготовленные в пробирках по 10—15 мл. Культуру вносят в пробирки с расплавленным и охлажденным 40 — 45°С агаром, а затем заливают смесь в чашку Петри. Возможен и другой способ глубинного посева: взвесь микроорганизмов вносят непосредственно в стерильную чашку Петри на дно, слегка приоткрыв крышку, а затем заливают ее расплавленным и охлажденным агаром. Среду с культурой тщательно перемешивают круговыми движениями чашки, не поднимая ее с поверхности стола и оставляют чашку на столе до застывания агара;
б) для поверхностного роста исследуем материал наносят на поверхность уже застывшей среды (рис. 1.8). Распределение материала по пластинке агара можно выполнить с помощью шпателя или бактериологической петли. При посеве шпателем (стеклянной палочкой, согнутой в виде треугольника) чашка с застывшей средой находится на поверхности стола. Левой рукой слегка приоткрывают крышку, а правой вносят на поверхность агара определенное количество (петлю, каплю или определенный объем) культуры. Круговыми движениями шпателя распределяют культуру по всей поверхности среды. При использовании для посева бактериологической петли осуществляют посев штриховым способом. Чашку Петри кладут на стол дном кверху и левой рукой поднимают только ее основание со средой; держат дно чашки в руке вертикально и осторожно, не взрыхляя среды, наносят культуру петлей зигзагообразными движениями (штрихом).
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 1763; Нарушение авторских прав?; Мы поможем в написании вашей работы!