
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Процесс,протекающий при постоянном объеме, называется изохорным.На диаграмме в координатах (p.t) он изображается прямой, называемой изохорой.
Процесс,протекающий при постоянном давлении, называется изобарным.На диаграмме в координатах (V,t) этот процесс изображается прямой, называемой изобарой.
Единица молярной массы - килограмм на моль (кг/моль).
7. Закон Дальтона.
Парциальное давление - давление, которое производил бы газ, входящий в состав газовой смеси, если бы он один занимал объем, равный объему смеси при той же температуре.
Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений p1,p2,...,pn входящих в нее газов:
p=p1+p2+…+pn или 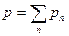
8. Закон Гей-Люссака.
1) Давление р данной массы т газа при постоянном объеме изменяется линейно с температурой t:
р = po(1+αt), при V = const, т = const.
2) Объем V данной массы т газа при постоянном давлении изменяется линейно с температурой t:
V = V0 (1+αt), при р= const; m= const.
где 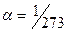 K-1V0 и р0 - объем и давление при t=0°С;
K-1V0 и р0 - объем и давление при t=0°С;
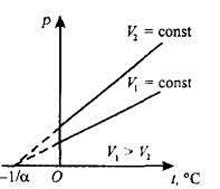
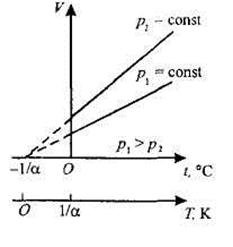
Изобары и изохоры пересекают ось температуры в точке t = -1/α = -273° С. Если начало отсчета сместить в эту точку, то получим шкалу Кельвина (термодинамическую температуру): Т=t+ .
.
В термодинамической шкале температур:
V = Vo(1 +αt) = VoαT, p = po(1+αt) = poαT
Откуда:

 или
или 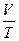 = const при р = const; m = const
= const при р = const; m = const
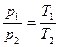 или
или 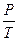 =const при V=const; m=const (з-н Шарля),
=const при V=const; m=const (з-н Шарля),
где индексы 1 и 2 относятся к произвольным состояниям, лежащим на одной изобаре или изохоре.
9. Уравнение состояния идеального газа.
Уравнением состояния термодинамической системы называется уравнение, которое связывает давление р, объем V итемпературу Т термодинамической системы, находящейся в состоянии термодинамического равновесия:
f(p,V,T) =0, где каждая из переменных является функцией двух других.
Пусть некоторая масса газа занимает объем V1 имеет давление р1 и находится при температуре T1. Эта же масса газа в другом произвольном состоянии характеризуется параметрами р2, V2,Т2. Переход из состояния 1 в состояние 2 осуществляется последовательно изотермическим (1-1') и изохорным (1/-2) процессами.
По законам Бойля-Мариотта и Гей-Люссака.
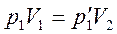

Исключая 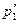 , получим уравнение состояния идеального газа:
, получим уравнение состояния идеального газа:
 или
или 
По закону Авогадро, при одинаковых р и Т моли всех газов занимают одинаковый молярный объем Vμ. Уравнение состояния для моля идеального газа: pVμ = RT, где константа R =8,31 Дж/(моль·К) - называется универсальной газовой постоянной.
Объем газа массы m: V =vVμ =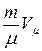 . Отсюда pV =
. Отсюда pV = = vRT
= vRT
Уравнение Клапейрона- Менделеева - уравнение состояния для массы т идеального газа:
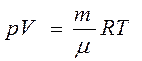
Если использовать постоянную Больцмана: 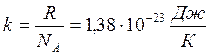
то уравнение состояния примет вид;
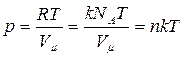
где п = 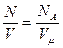 - концентрация молекул - число молекул в единице объема.
- концентрация молекул - число молекул в единице объема.
Таким образом:
1) давление идеального газа при данной температуре прямо
пропорционально концентрации его молекул,
2) при одинаковых температуре и давлении все газы содержат в единице
объема одинаковое число молекул.
Число молекул, содержащихся в 1 м3 газа при нормальных условиях, называется числом Лошмидта.
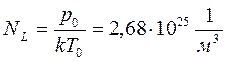
10. Основное уравнение молекулярно-кинетической теории идеальных газов.
Пусть в сосуде объемом V находится идеальный газ массой m, состоящий из N молекул массой т0, движущихся с одинаковыми скоростями v. Концентрация молекул в газе по определению n = N/V.
Если при соударениях со стенками за время 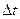 элементарной площадке
элементарной площадке 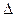 S стенки сосуда передается импульс
S стенки сосуда передается импульс 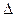 Р, то давление газа, оказываемое им на стенку сосуда
Р, то давление газа, оказываемое им на стенку сосуда
р = .
.
При каждом соударении молекула, движущаяся перпендикулярно стенке, передает ей импульс 2m0v. В среднем по направлению к стенке движется 1/6часть всех молекул. (Если рассмотреть три взаимно перпендикулярные оси, то в среднем только 1/2молекул движется вдоль одной из осей итолько половина из них ½(1/3) вдоль данного направления.) Поэтому, за время ∆ t площадки ∆ S достигнут  молекул и передадут ей импульс
молекул и передадут ей импульс 
Давление, оказываемое газом на стенку сосуда: р = 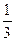 nmov2.
nmov2.
Если газ в объеме V содержит N молекул, движущихся со скоростями vl,v2,...,vN, то целесообразно рассматривать среднюю квадратичную скорость, которая определяется как 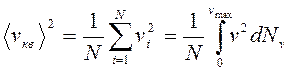
и характеризует всю совокупность молекул газа.
Основное уравнение молекулярно-кинетической теории идеальных газов; 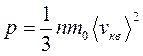
Другие варианты записи этого уравнения с учетом соотношений п = N/V и m = Nm0 → 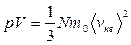
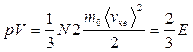
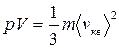

Здесь Е - суммарная кинетическая энергия поступательного движения всех молекул газа, Vμ - молярный объем, μ -молярная масса.
Используя уравнение Клапейрона - Менделеева, получим RT = 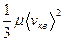 , откуда
, откуда
11. Средняя квадратичная скорость молекул идеального газа:

где использовано μ= m0NА и k = R/NА.
Средняя кинетическая энергия поступательного движения одной молекулы идеального газа:
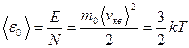
Отсюда следует, что 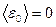 при Т =0 К- прекращается движение молекул газа.
при Т =0 К- прекращается движение молекул газа.
Молекулярно-кинетическое толкование температуры: термодинамическая температура - есть мера средней кинетической энергии поступательного движения молекул газа.
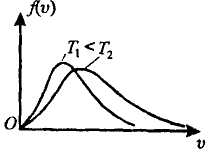
12. Закон Максвелла о распределении молекул идеального газа по скоростям.
В газе, находящемся в состоянии равновесия при данной температуре, устанавливается некоторое стационарное, не меняющееся со временем распределение молекул по скоростям. Это распределение описывается функцией f(v), называемой функцией распределения молекул по скоростям, которая определяет относительное число молекул, скорости которых лежат в интервале от и до v + dv, т.е.
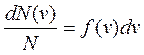
Закон Максвелла:

Эта функция удовлетворяет условию нормировки. 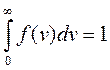
13. Наиболее вероятная скорость молекул идеального газа.
Скорость, при которой функция распределения молекул идеального газа по скоростям максимальна, называется наиболее вероятной скоростью v в.
Приравняв  нулю, получаем:
нулю, получаем: 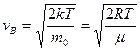
С повышением температуры v в растет.
14. Средняя скорость молекулы газа (средняя арифметическая скорость)
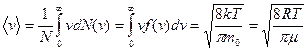

16. Барометрическая формула.
В однородном поле тяготения Земли тепловое движение молекул приводит к некоторому стационарному состоянию газа, при котором давление газа с высотой убывает. Давление на высоте h газа с молярной массой μ относительно уровня моря, где давление р0 считается нормальным, равно
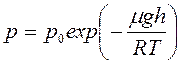
|
|
Дата добавления: 2013-12-13; Просмотров: 501; Нарушение авторских прав?; Мы поможем в написании вашей работы!