
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 7. 2.24. Реальные газы. Уравнение Ван – дер - Ваальса
|
|
|
|
2.24. Реальные газы. Уравнение Ван – дер - Ваальса
Модель идеального газа хорошо описывает процессы, происходящие в разреженных газах. При этом используется уравнение состояния идеального газа - уравнение Менделеева - Клапейрона. Однако с увеличением концентрации молекул становятся заметными отклонения поведения реальных газов от поведения, соответствующего идеальному газу.
Это связано, во-первых, с необходимостью учета сил притяжения между молекулами реального газа, и, во-вторых, при больших плотностях газа начинает сказываться наличие у молекул собственного объема - это приводит к тому, что не весь объем газа будет доступен молекулам.
1. Влияние сил притяжения. Рассмотрим сначала влияние сил притяжения между молекулами реального газа на вид уравнения Менделеева - Клапейрона.
На рис. 2.20,а приведен график зависимости потенциальной энергии взаимодействия 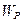 частиц от расстояния
частиц от расстояния 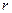 между ними (одна молекула находится в начале оси
между ними (одна молекула находится в начале оси 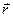 ). Движению молекул в газе соответствует полная энергия
). Движению молекул в газе соответствует полная энергия 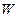 частицы, принимающая положительные значения (рис. 2.20,а).
частицы, принимающая положительные значения (рис. 2.20,а).
Между потенциальной энергией молекул и силами, действующими между ними, существует формула связи ( ), которая позволяет построить график зависимости проекции результирующей силы, действующей между молекулами, от расстояния между ними (рис.2.20,б). Напомним, что результирующая сила складывается из сил притяжения молекул (они вызваны
), которая позволяет построить график зависимости проекции результирующей силы, действующей между молекулами, от расстояния между ними (рис.2.20,б). Напомним, что результирующая сила складывается из сил притяжения молекул (они вызваны
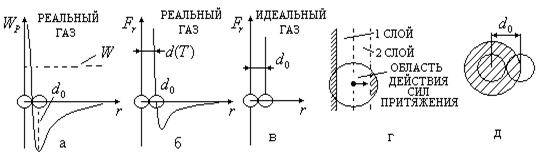 |
Рис. 2.18
взаимодействием разноименных зарядов молекул - ядра одной молекулы с электронной оболочкой другой молекулы) и сил отталкивания (они связаны с взаимодействием одноименных зарядов молекул - ядра одной молекулы с ядром другой молекулы или электронной оболочки одной молекулы с электронной оболочкой другой молекулы).
Согласно графику 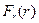 , приведенному на рис. 2.18,б, результирующая сила взаимодействия между молекулами на расстояниях
, приведенному на рис. 2.18,б, результирующая сила взаимодействия между молекулами на расстояниях  является силой притяжения (она является короткодействующей и быстро спадает до нуля на расстояниях порядка
является силой притяжения (она является короткодействующей и быстро спадает до нуля на расстояниях порядка 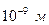 ), а для расстояний
), а для расстояний 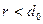 - силой отталкивания (
- силой отталкивания (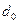 -диаметр молекулы; он соответствует минимуму потенциальной энергии взаимодействия двух молекул при малых скоростях их движения).
-диаметр молекулы; он соответствует минимуму потенциальной энергии взаимодействия двух молекул при малых скоростях их движения).
График 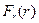 для реального газа (рис. 2.18,б) отличается от графика
для реального газа (рис. 2.18,б) отличается от графика 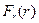 для идеального газа (рис.2.18,в) прежде всего наличием сил притяжения между молекулами. При больших концентрациях газа (плотный газ) молекулы достаточно долго будут находиться на расстояниях, на которых действуют силы притяжения, что создает добавочное давление (его называют внутренним давлением
для идеального газа (рис.2.18,в) прежде всего наличием сил притяжения между молекулами. При больших концентрациях газа (плотный газ) молекулы достаточно долго будут находиться на расстояниях, на которых действуют силы притяжения, что создает добавочное давление (его называют внутренним давлением 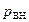 ) внутри реального газа по сравнению с идеальным газом.
) внутри реального газа по сравнению с идеальным газом.
Это внутреннее давление 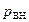 уменьшает скорость молекул, ударяющихся о стенку сосуда. Покажем это. Выделим вблизи стенки сосуда первый слой молекул, которые движутся без столкновений до нее (на рис. 2.18,г молекула газа изображена в виде материальной точки). Второй слой молекул, отстоящий от стенки дальше первого, будет притягивать его к себе, что уменьшает скорость молекул идеального газа первого слоя и тем самым уменьшает давление
уменьшает скорость молекул, ударяющихся о стенку сосуда. Покажем это. Выделим вблизи стенки сосуда первый слой молекул, которые движутся без столкновений до нее (на рис. 2.18,г молекула газа изображена в виде материальной точки). Второй слой молекул, отстоящий от стенки дальше первого, будет притягивать его к себе, что уменьшает скорость молекул идеального газа первого слоя и тем самым уменьшает давление  газа на стенки сосуда. Поэтому давление внутри реального газа будет равно сумме давления
газа на стенки сосуда. Поэтому давление внутри реального газа будет равно сумме давления  на газ со стороны стенок сосуда (внешнее давление) и внутреннего давления
на газ со стороны стенок сосуда (внешнее давление) и внутреннего давления 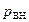 :
: 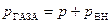 .
.
Следовательно, учет сил притяжения между молекулами приводит к тому, что в уравнение Менделеева - Клапейрона необходимо подставить выражение
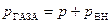 .
.
Внутреннее давление можно оценить следующим образом. Оно возникает при взаимодействии молекул первого и второго слоев, т.е. будет пропорциональным количеству молекул в этих слоях, т.е. концентрации молекул газа
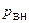 ~
~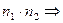
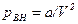 ,
,
где введен коэффициент пропорциональности 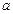 , который можно установить из опыта.
, который можно установить из опыта.
Из рис. 2.18,г видно, что сила притяжения, действующая на молекулу первого слоя со стороны второго, вызвана тем, что в область действия сил притяжения выделенной молекулы (сфера) первого слоя попадает частично стенка сосуда. Это уменьшает область действия сил притяжения до усеченной сферы, что и приводит к возникновению притяжения молекул первого слоя к молекулам второго слоя. Внутри газа эти силы притяжения, действующие на молекулу, уравновешивают друг друга.
2. Влияние сил отталкивания. При больших плотностях газа заметную роль начинает играть собственный объем молекул. Действующие между молекулами силы на малых расстояниях становятся силами отталкивания. Они не позволяют центрам двух молекул при столкновении сблизиться до расстояний, меньших 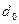 (
(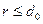 ). Следовательно, при столкновении двух молекул недоступным для них будет объем сферы диаметром
). Следовательно, при столкновении двух молекул недоступным для них будет объем сферы диаметром 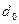 (см. рис. 2.18,д), этот объем будет равен восьми объемам
(см. рис. 2.18,д), этот объем будет равен восьми объемам 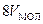 молекулы, а для одной молекулы недоступным будет половина этого объема:
молекулы, а для одной молекулы недоступным будет половина этого объема: 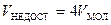 . Тогда объем, доступный для молекул идеального газа, будет равен
. Тогда объем, доступный для молекул идеального газа, будет равен
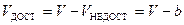 ,
,
где буквой  обозначен недоступный для молекул объем.
обозначен недоступный для молекул объем.
В случае идеального газа диаметр молекул не зависит от температуры, так как при столкновении молекул силы взаимодействия резко возрастают (рис. 2.18,в). Для реального газа силы отталкивания хотя и резко возрастают при столкновении молекул, но, тем не менее, зависимость их от расстояния позволяет изменяться диаметру молекулы при столкновении 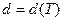 . Ввиду слабой зависимости диаметра молекулы от температуры ею можно пренебречь.
. Ввиду слабой зависимости диаметра молекулы от температуры ею можно пренебречь.
Учет двух поправок видоизменяет уравнение состояния идеального газа следующим образом:
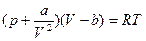 . (2.86)
. (2.86)
Это уравнение записано для одного моля газа (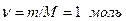 ), в нем объем газа является молярным объемом
), в нем объем газа является молярным объемом 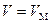 ). Для произвольной массы газа в уравнении (2.86) нужно произвести замену
). Для произвольной массы газа в уравнении (2.86) нужно произвести замену 
 . (2.87)
. (2.87)
Уравнение (2.86) было впервые получено Ван-дер-Ваальсом.
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 637; Нарушение авторских прав?; Мы поможем в написании вашей работы!