
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Комплексометрическое титрование
|
|
|
|
ПРИМЕРЫ.
1. В минеральной воде содержание ионов SO42– можно определить по такой схеме. Пробу воды (100 мл) подкисляют соляной кислотой и кипятят. При этом удаляется мешающий определению гидрокарбонат:
HCO3– + H+ ® H2O + CO2.
Затем раствор нейтрализуют и действуют на него нитратом или хлоридом бария. При этом выпадает нерастворимый сульфат бария:
Ba2+ + SO42– ® BaSO4¯.
Осадок промывают, сушат и взвешивают. По массе BaSO4 рассчитывают количество сульфата в пробе.
2. Содержание меди в руде можно определить электрогравиметрическим методом.
Для этого образец руды растворяют в азотной кислоте и ведут электролиз с платиновым катодом. Раствор предварительно нейтрализуют до слабокислой реакции, а катод – взвешивают. Обычно сопутствующие меди металлы (Fe, Co, Ni, Zn, Cd) имеют отрицательный электродный потенциал и в этих условиях не осаждаются. Катод после электролиза высушивают и взвешивают. Привес даёт содержание меди в образце.
В газовом анализе измеряют объёмы газа и его составных частей.
Титриметрическим анализом называют определение точного объёма раствора химического реактива, необходимого для полного протекания реакции с раствором исследуемого вещества.
Концентрация приливаемого раствора (титранта) должна быть известна точно.
В аналитической химии часто концентрацию растворов выражают не в молях на литр, а в эквивалентах на литр.
1. Эквивалентом называют количество вещества, вступающее в реакцию с одним молем ионов водорода, ионов гидроксила или электронов, или отдающее один моль этих частиц.
2. Эквивалентом называют количество вещества, вступающее в реакцию с 1 г водорода или с 8 г кислорода, или с 96485 кулонами электричества.
Для кислот, оснований и металлов: Э=M/k, где Э – масса эквивалента, M – молярная масса, k – число ионов водорода в кислоте, ионов гидроксила в основании или число электронов, отдаваемых металлом при окислении.
ПРИМЕР. В реакции нейтрализации
H2SO4 + 2NaOH ® Na2SO4 + 2H2O
эквивалентная масса H2SO4: Э1= 98г/моль /2 экв/моль = 49 г/экв (k=2),
эквивалентная масса NaOH: Э2= 40г/моль /1 экв/моль = 40 г/экв (k=1).
Как видно, эквивалентная масса либо равна молярной, либо в несколько раз меньше неё. Число эквивалентов считают сходно с числом молей: nЭ=m/Э.
Выполняется важный закон эквивалентов:
вещества вступают в реакцию в эквивалентных количествах – один эквивалент одного реагирует с одним эквивалентом другого.
Концентрацию раствора, выраженную в эквивалентах на литр, называют нормальной концентрацией. В рассмотренном случае одномолярная (1 M) H2SO4 является двунормальной (2 N или 2 н.).
Нормальная концентрация:
СN=nЭ/V (число эквивалентов растворённого вещества в 1 л раствора).
Различают несколько методов титриметрического анализа.
– КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ.
К кислому раствору по каплям приливают щёлочь известной концентрации (или, наоборот, к щелочному приливают кислоту). В точке эквивалентности происходит нейтрализация, смена окраски индикатора и резкий скачок pH. Если контролируют потенциал электрода, зависящий от pH, титрование называют потенциометрическим.
– ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЕ ТИТРОВАНИЕ.
Обычно к раствору, содержащему восстановитель, приливают окислитель, например, раствор KMnO4 (перманганатометрия) или иода (иодометрия). Точку эквивалентности определяют по моменту, когда добавляемый раствор перестаёт изменять окраску или обесцвечиваться.
– ОСАДИТЕЛЬНОЕ ТИТРОВАНИЕ.
Исследуемый ион осаждают в виде нерастворимого осадка. Например, хлорид осаждают раствором AgNO3 (аргентометрия) в нейтральной или слабощелочной среде:
Ag+ + Cl– ® AgCl ¯.
В раствор предварительно добавляют немного хромата натрия Na2CrO4. Он имеет лимонный цвет. В точке эквивалентности на фоне творожистого белого осадка AgCl появляется красный осадок хромата серебра:
2Ag+ + CrO42– ® Ag2CrO4 ¯.
Исследуемые ионы связывают в комплексы. Чаще всего используют связывание катионов металла с анионом ЭДТА (этилендиаминтетраацетатом):
(OOCCH2HN)2CH2–CH2(NHCH2COO)24–
(будем обозначать его T4–).
Для титрования берут соль Na2H2T (её называют " трилон Б "). Это – кислая соль, свои два кислотных водорода анион легко замещает на металл:
H2T2– + M2+ ® MT2– + 2H+.
ЭДТА связывается с M2+ сразу двумя группами COO– в очень прочный комплекс.
Трилон Б используют для удаления накипи, предотвращения её образования, для анализа жёсткости воды.
20. ЖЁСТКОСТЬ ВОДЫ
Жёсткостью воды называют содержание в ней многозарядных катионов металлов.
В природных водах это обычно Ca2+ и Mg2+, в некоторых есть и железо (обычно Fe2+). Выражают жёсткость (Ж), как и нормальную концентрацию, в экв/л.
Если Ж<4 миллиэквивалентов на литр (мэкв/л), вода считается мягкой, если Ж>8 мэкв/л – жёсткой, в промежутке – средней жёсткости.
Временная жёсткость связана с наличием ионов гидрокарбоната HCO3-. При нагревании он превращается в нерастворимые карбонаты (накипь):
Ca2+ + 2HCO3- ® CaCO3¯ + H2O + CO2.
кальцит
В присутствии магния в осадок выпадает твёрдый раствор на основе кальцита:
(1–x)Ca2+ + xMg2+ + 2HCO3- ® Ca1–xMgxCO3¯ + H2O + CO2.
твёрдый раствор (обычно x»0,1)
В отсутствие кальция с солями магния может также происходить частичный гидролиз (с образованием осадка основных солей, например, гидромагнезита Mg(OH)2×4MgCO3×4H2O), а при более сильном нагреве – полный гидролиз:
Mg2++ 2HCO3- ® Mg(OH)2¯ + 2CO 2.
брусит
Помимо образования накипи, жёсткость снижает эффективность моющих средств, особенно, мыла.
Мыла – это натриевые или калиевые соли жирных кислот: стеариновой C17H35COOH, олеиновой C17H33COOH, пальмитиновой C15H31COOH и других. Кратко их обозначают RCOOH, где R – углеводородный радикал, например, C17H35. Жирные кислоты – слабые и легко вытесняются из мыла даже уксусной кислотой:
C17H35COO– + CH3COOH ® C17 H35COOH¯ + CH3COO–.
стеариновая кислота (стеарин)
В жёсткой воде мыла дают нерастворимые соли кальция и магния:
2RCOONa + CaCl2 ® (RCOO)2Ca¯ + 2 NaCl,
2RCOO- + Ca2+ ® (RCOO) 2Ca¯.
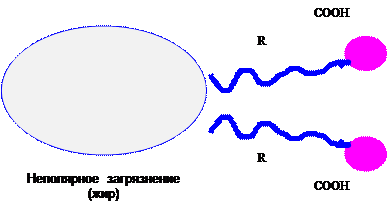
Вообще же действие моющих средств основано на том, что их молекулы или ионы имеют полярный конец (группа COOH) и неполярный хвост (группа R). За счёт полярного конца они растворимы в воде и способны растворять загрязнения с полярной связью. Но, главное, за счёт неполярного органического радикала, в раствор уносятся нерастворимые в воде загрязнения, например, жиры.
Основа стиральных порошков – органические производные серной кислоты сульфонаты натрия NaSO3R. Сульфонаты кальция и магния хорошо растворимы в воде, поэтому такие моющие средства применимы и в жёсткой воде.
 |
Определяют временную жёсткость кислотно-основным титрованием. К исследуемой воде приливают соляную кислоту в присутствии индикатора метилоранжа:
HCO3- + H+ ® H2O + CO2.
В точке эквивалентности индикатор меняет окраску с жёлтой на красную.
ПРИМЕР. Определить временную жёсткость воды, если на титрование 200 мл этой воды израсходовано 10 мл 0,1 н. раствора HCl.
РЕШЕНИЕ. По закону эквивалентов, число эквивалентов кальция и магния равно числу эквивалентов кислоты:
VHCl × NHCl= VH2O × ЖH2O
Отсюда Ж = 10 мл × 0,1 экв/л / 200 мл = 0,005 экв/л = 5 мэкв/л.
Постоянная жёсткость связана с содержанием всех других анионов, кроме гидрокарбоната HCO3-. В природной воде это обычно сульфаты и хлориды (конечно же, это соли кальция или магния). Она не удаляется кипячением, не даёт накипи, но может превращаться во временную благодаря поглощению CO2 из атмосферы.
Общую жёсткость определяют титрованием трилоном Б в присутствии буферной смеси (NH4OH+NH4Cl, для поддержания pH= 9–10). Индикатор – эриохром (E). С ионами Mg2+ он даёт розовое окрашивание, без них его водный раствор синий.
В точке эквивалентности, когда трилон Б связывает все ионы Ca2+ и Mg2+, розовая окраска переходит в синюю:
MgE + H2T2– ® H2E + MgT2–.
розовый синий
В котельных воду предварительно умягчают содой Na2CO3 или фосфатом натрия Na3PO4:
Na2CO3 + CaCl2 ® CaCO3 ¯ + 2NaCl,
CO32- + Ca2+ ® CaCO3 ¯.
ХАРАКТЕРИСТИКИ ОТДЕЛЬНЫХ ЭЛЕМЕНТОВ-металлов
21. Примеры характеристики элементов.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 727; Нарушение авторских прав?; Мы поможем в написании вашей работы!