
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Зависимость скорости реакции от температуры
|
|
|
|
Сумма показателей степени в кинетическом уравнении реакции называется порядком реакции (п).
В простой реакции или в какой-либо стадии сложной реакции могут принимать участие одна, две или три молекулы. Этот признак характеризует молекулярность реакции.
Молекулярность реакции
По этому признаку различают – мономолекулярные, бимолекулярные, тримолекулярные и т. д. реакции.
Мономолекулярные реакции представляют собой самопроизвольный распад одной молекулы, би- и тримолекулярные - результат соударения соответственно двух или трех молекул.
Вероятность осуществления реакции зависит от ее молекулярности. Наиболее часты бимолекулярные реакции. Тримолекулярные реакции более редки, а тетрамолекулярные - почти не встречаются.
Различают суммарный порядок реакции (т. е. сумма показателей степени в кинетическом уравнении) и частные порядки по какому-либо из реагентов, т. е. показатели степени при концентрации данного вещества в кинетическом уравнении.
Если сумма показателей степени в кинетическом уравнении составляет единицу, то реакцию называют реакцией первого порядка, если она равна двум — реакцией второго порядка и т. д. Порядок реакции может быть нулевым и дробным.
Если реакция имеет нулевой порядок, то скорость реакции не зависит от концентрации реагента:
V = k [А]0 = k
При повышении температуры скорость реакций, как правило, резко возрастает. Например, при комнатной температуре скорость взаимодействия водорода с кислородом практически нулевая, при 400°С она делается заметной, хотя и остается небольшой, а при 600°С реакция протекает со взрывом.
Число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры на 10°С, называется температурным коэффициентом скорости (γ) этой реакции.
Для большинства реакций γ равно 2-3 (правило Вант-Гоффа).
Зная величину γ, а также скорость реакции при одной температуре Т1, можно вычислить ее скорость при другой температуре Т2, воспользовавшись уравнением:

При расчетах по этому уравнению нетрудно заметить, что при повышении температуры скорость реакции возрастает очень резко. Так, если γ = 2, то повышение температуры, например, от 0 °С до 100 °С приводит к повышению скорости реакции в 2100/10=210=103 раз.

Объяснить столь резкое увеличение скорости реакции одним только увеличением числа соударений между частицами реагентов за счет возрастания скорости их движения (вычисляемой на основании кинетической теории газов) нельзя. Причина заключается в том, что для акта химического взаимодействия само по себе столкновение частиц реагентов еще недостаточно. Молекулы могут разойтись после столкновения, даже не прореагировав. Доля "успешных" столкновений зависит как от природы взаимодействующих частиц, так и от энергии, которой они обладают.
Для того чтобы молекулы могли прореагировать, они должны обладать запасом энергии, равным или большим некоторой величины, которая называется энергией активации (Еа).
Если большое число молекул заключено при постоянной температуре в некотором объеме, то за счет хаотических соударений в результате теплового движения запас энергии у разных молекул будет различным. Какая-то доля молекул будет обладать наиболее вероятным запасом энергии ЕW. Количество молекул N, обладающих иным запасом энергии, будет меньшим, чем больше их энергия отличается от ЕW.

Рисунок 2 – Распределение молекул по энергии:
1- При температуре Т1; 2– при температуре Т2, где Т2 > Т1.
На рис. 2 (кривая 1) показано типичное распределение молекул по энергии при постоянной температуре Т1. При повышении температуры до Т2 ЕWвозрастает ( ЕW '2 > ЕW 1), и кривая распределения молекул по энергии сдвигается в сторону больших энергий (кривая 2), что приводит к возрастанию во много раз доли молекул, обладающих энергией, равной или большей Еакт (заштрихованная область на рисунке). Это и является причиной резкого увеличения скорости химических реакций при повышении температуры.
Зависимость скорости реакции от температуры выражается уравнением Аррениуса:
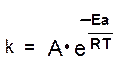
где k— константа скорости реакции;
А - предэкспоненциальный множитель (коэффициент, отражающий природу реагирующих веществ);
Еа — энергия активации для данного процесса;
R — универсальная газовая постоянная;
Т - абсолютная температура.
Если с помощью молекулярно-кинетической теории газов и жидкостей подсчитать число соударений между молекулами тех или иных веществ, при определенных условиях, то окажется, что число соударений столь велико, что все реакции должны протекать мгновенно. Однако в действительности далеко не все реакции заканчиваются быстро. Это противоречие можно объяснить, если предположить, что не всякое столкновение молекул реагирующих веществ, приводит к образованию продуктов реакции. Для того чтобы это произошло, необходимо сначала разорвать или ослабить связи между атомами в молекулах исходных веществ. На это надо затратить определенную энергию. Если сталкивающиеся молекулы не обладают такой энергией, то столкновение не приведет к образованию новой молекулы.
Если же кинетической энергии сталкивающихся молекул достаточно для ослабления или разрыва связей, то столкновение может привести к перестройке атомов с образованием переходного состояния (активированного комплекса) и затем к образованию молекулы нового вещества:
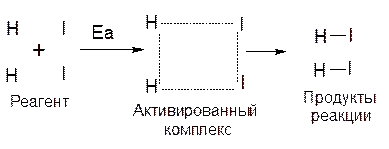
Итак, для акта химического взаимодействия необходимо, чтобы частицы реагентов как бы преодолели некий энергетический барьер - активационный барьер. Частицы, обладающие достаточной энергией, чтобы "взойти" на активационный барьер, образуют неустойчивую переходную группировку атомов, которую называют активированным комплексом (АК).
В состоянии АК связи в исходных частицах ослаблены, как бы надорваны, и уже образуются новые связи, которые, однако, еще не стали такими же прочными, как в конечных веществах. Энергия, которая выделяется при частичном образовании новых связей, отчасти компенсирует энергию, необходимую для разрыва старых связей, что понижает активационный барьер. Рассмотрим роль образования АК на примере образования воды из водорода и кислорода.
Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активации данной реакции. Ее определяют опытным путем, обозначают Еа и обычно выражают в [кДж/моль]. Молекулы, обладающие такой энергией, называются активными молекулами.
|
|
|
Дата добавления: 2013-12-13; Просмотров: 951; Нарушение авторских прав?; Мы поможем в написании вашей работы!