КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Практичне заняття З
|
|
|
|
ПОЖИВНІ СЕРЕДОВИЩА. ТЕХНІКА ПОСІВУ НА ПОЖИВНІ СЕРЕДОВИЩА
Мета заняття:
— уміти проводити взяття та посів патологічного матеріалу на поживні середовища;
— уміти характеризувати ріст мікроорганізмів на поживних середовищах.
Оснащення: сухі та виготовлені поживні середовища: поживний бульйон, Ендо, ЕМС (Левіна), Гісса, виготовлене середовище ЖСА, бактеріологічні петлі, шпатель для посіву, тампон для зіва, бульйонна культура ешерихій (посівний матеріал), середовище Ендо, кров'яний агар, ЖСА, кольоровий ряд Гісса, МПБ з індикаторними паперовими смужками з ростом культури бактерій, спиртівка, сірники, маркер, гумові рукавички.
План
1. Ознайомлення з поживними середовищами.
2. Техніка посіву патологічного матеріалу на поживні середовища бактеріологічною петлею, тампоном, шпателем.
3. Принципи культивування аеробних і анаеробних мікроорганізмів.
4. Етапи виділення чистої культури мікроорганізмів. Ідентифікація чистих культур мікроорганізмів.
ч у Хід заняття 1. Ознайомлення з поживними середовищами
Завдання 1. Ознайомтеся з формою випуску, умовами зберігання сухих поживних середовищ.
Сухі поживні середовища випускаються у флаконах із темного скла, пластика або у непрозорих пакетах, зроблених із щільного паперу, алюмінієвої фольги (середовища світлочутливі). Посуд, у якому випускають ці середовища, щільно закривають, пробки додатково заливають парафіном, пакети запаюють (середовища гігроскопічні). На флаконах і пакетах обов'язково має бути етикетка, на якій зазначено: назву середовища, призначення, склад, спосіб приготування, термін і умови зберігання, серію. Готують поживні середовища згідно з інструкцією, зазначеною на етикетці.
2. Техніка посіву патологічного матеріалу на поживні середовища бактеріологічною петлею, тампоном, шпателем
Завдання 2. Проведіть посів бактеріологічною петлею на щільне поживне середовище Ендо.
Посів на поживні середовища проводять для бактеріологічного дослідження з метою виділення чистої культури мікроорганізмів та її ідентифікації. Для посіву може бути використаний як патологічний матеріал, так і культура мікроорганізмів.
Чисту культуру виділяють з однієї колонії, тому посів роблять так, щоб виросли ізольовані колонії. Для цього використовують такі прийоми: поверхня середовища має бути підсушеною (не повинно бути крапельок конденсаційної вологи), посівний матеріал — розведеним і добре розмішаним, лінія посіву — максимально довгою.
Всі маніпуляції, пов'язані з посівом і виділенням культур мікроорганізмів, проводять в асептичних умовах. Під час посіву не розмовляють, не роблять зайвих рухів; роботу виконують швидко, посіви тримають не далі ніж на 10 см від полум'я.
Увага! Під час роботи з живою культурою дотримуйтеся правил техніки безпеки!
Алгоритм "Посів на щільне поживне середовище бактеріологічною петлею":
— поставте чашку Петрі донизу дном зліва від спиртівки;
— зафламбуйте бактеріологічну петлю, візьміть матеріал для посіву із пробірки;
Увага! Матеріал для посіву в кільці бактеріологічної петлі утворює плівку "дзеркальце".
— підніміть правою рукою кришку чашки Петрі так, щоб в щілину між кришкою та її дном пройшла бактеріологічна петля;
— втирайте патологічний матеріал бактеріологічною петлею в поверхню поживного середовища біля краю чашки;
— зафламбуйте бактеріологічну петлю;
— охолодіть бактеріологічну петлю, доторкнувшись її кінцем до внутрішньої сторони стінки чашки Петрі;
— покладіть бактеріологічну петлю на те місце на поверхні середовища, де нанесли патологічний матеріал;
— продовжіть робити посів штрихами по всій поверхні чашки, не відриваючи петлі від середовища;
Увага! Штрихи наносять через всю поверхню середовища від однієї стінки чашки до іншої (протилежної) і розташовують їх якомога ближче один від одного. Завдяки цьому лінія посіву стає якнайдовшою, що дає змогу отримати ізольовані колонії.
—- закрийте чашку Петрі;
— зафламбуйте бактеріологічну петлю, поставте її в банку; —- закрийте спиртівку;
— підпишіть на кришці чашки назву поживного середовища і дату його виготовлення;
— переверніть чашку дном догори, підпишіть номер, дату посіву, назву культури за бінарною номенклатурою.
Увага! Підпис посуду здійснюється відповідно до Державних санітарних правил (ДСП 9.9.5.-080-02).
Завдання 3. Проведіть посів бактеріологічною петлею у рідке поживне середовище (МПБ).
Під час посіву у МПБ матеріал розітріть на сухій внутрішній поверхні пробірки біля середовища, нахиліть пробірку і змийте матеріал у середовище. Цієї вимоги слід дотримуватися обов'язково, особливо у випадках посіву в'язкої культури.

Алгоритм "Посів петлею у рідке поживне середовище": — візьміть бактеріологічну петлю в праву руку, зафламбуй-
те її;
— візьміть чашку Петрі з культурою у ліву руку;
— охолодіть петлю, доторкнувшись до внутрішньої стінки чашки;
— заберіть матеріал з однієї колонії;
— поставте чашку Петрі, візьміть пробірку з МПБ;
— візьміть мізинцем правої руки пробку пробірки і притисніть її до долоні;
Увага! Пробку постійно тримайте в руці.
— зафламбуйте отвір пробірки;
— тримайте пробірку біля полум'я так, щоб отвір її був не далі як на 10 см від полум'я;
— уведіть петлю в пробірку, розітріть на її стінці матеріал;
— опустіть петлю в поживне середовище, змийте матеріал зі стінки пробірки;
— вийміть петлю з пробірки, не торкаючись її стінок;
— зафламбуйте отвір пробірки, закрийте її пробкою;
— поставте пробірку у штатив;
— зафламбуйте петлю, поставте її в склянку з інструментом.
Завдання 4. Ознайомтеся з видами тампонів, що використовуються для взяття паталогічного матеріалу.
Посів проводять тампоном, яким було відібрано матеріал для дослідження.
Тампони виготовляють шляхом намотування вати на металевий, скляний або дерев'яний стержень. Тампони бувають для зіва (ротоглотки) і носа, а також ректальні (для взяття патологічного матеріалу із прямої кишки). Тампони для ротоглотки і носа виготовляють так: на кінчик стержня туго намотують вату, а посередині його роблять ватну пробку. Вата кінчика і пробки не повинна сполучатися між собою, в іншому випадку, якщо такий тампон опустити в рідке поживне середовище, то воно, за законом капілярності, буде поглинуте тампоном. Ці тампони використовують для взяття патологічного матеріалу не тільки з ротоглотки, носа, а й з вуха, виразки, абсцесу, рани, а також для взяття змивів з рук і поверхні різних об'єктів навколишнього середовища.
Ректальні тампони виготовляють так: туго намотують вату на кінці стержня, потім навколо стержня на довжину 10— 12 см, потім роблять ватну пробку.
Виготовлені тампони вміщують у пусті чисті сухі пробірки і стерилізують у автоклаві за температури 120 °С протягом 20 хв.
Завдання 5. Проведіть взяття патологічного матеріалу з носа.
Патологічний матеріал з носа беруть ватним тампоном під час обстеження на дифтерію, стафілококове носійство, а також у разі ураження слизової оболонки носа при вірусних респіраторних інфекціях.
Алгоритм "Взяття патологічного матеріалу ватним тампоном з носа":
— запропонуйте пацієнту сісти обличчям до світла;
— підпишіть на пробірці тампона номер аналізу;
— візьміть тампон у праву руку, звільніть його від пробірки;
— зробіть огляд носових ходів (чи немає пошкоджень слизової оболонки);
—- уведіть тампон у носовий хід до кінця ходу;
Увага! Не можна торкатися тампоном зовнішньої поверхні носа.
— зберіть слиз зі стінок одного носового ходу, добре притискуючи тампон;
— зберіть слиз зі стінок другого носового ходу цим самим тампоном, не обертаючи його навколо осі;
— опустіть тампон у пробірку.
Завдання 6. Проведіть посів тампоном на поживне середовище ЖС А.
Посів на поживні середовища тампоном роблять за тим самим принципом, що і бактеріологічною петлею, тобто необхідно добре втерти матеріал на невеликій площі, обертаючи тампон навколо його осі, а потім зробити посів зигзагоподібними штрихами. Лінія посіву має бути якомога довшою з тим, щоб отримати ізольовані колонії.
Посів можна робити коловими рухами, обертаючи тампон і чашку Петрі.
Увага! Під час посіву патологічного матеріалу дотримуйтесь правил асептики і техніки безпеки!
\/ Алгоритм "Посів тампоном на пластинчасті середовища":
— підпишіть чашку Петрі з середовищем ЖСА (на кришці — назву середовища і дату виготовлення, на дні — номер аналізу, назву культури, дату посіву);
— запаліть спиртівку, поставте ліворуч від неї підписану чашку Петрі із середовищем ЖСА дном догори;
— візьміть тампон у праву руку;
— візьміть чашку із середовищем ЖСА у ліву руку, піднесіть її до полум'я не далі ніж на 10 см;
— зробіть посів тампоном зигзагоподібними штрихами;
— закрийте чашку;
— закрийте спиртівку;
— опустіть тампон у пробірку.
Завдання 7. Проведіть посів шпателем.
Алгоритм "Проведення посіву шпателем":
— підпишіть чашку Петрі з ЕМС;
— нанесіть на поверхню середовища піпеткою чи бактеріологічною петлею одну краплю посівного матеріалу або тампоном на сегмент 1x2;
— візьміть у праву руку шпатель (тримайте його як олівець), зніміть з нього папірець, швидко зафламбуйте шпатель;
— покладіть його на нанесену краплю посівного матеріалу на поверхні поживного середовища;
— зробіть посів шпателем (робіть шпателем колові рухи правою рукою, прокручуйте чашку лівою рукою);
Увага! За такого методу посіву отримують рясний ріст мікроорганізмів по всій поверхні поживного середовища. Такий посів називається суцільним, або посів газоном.
— закрийте чашку, поставте її догори дном;
— опустіть шпатель у дезінфекційний розчин.
3. Принципи культивування аеробних і анаеробних мікроорганізмів
Умови, необхідні для культивування мікроорганізмів у мікробіологічній лабораторії, забезпечуються в термостаті.
Завдання 8. Ознайомтеся з будовою термостату, поставте посіви у термостат.
Термостат призначений для підтримання у внутрішній частині робочої камери стабільної температури, необхідної для проведення бактеріологічних і серологічних досліджень.
Основними частинами термостату є: корпус, металеві дверцята, прозорі дверцята, робоча камера, блок управління. Корпус виготовлений із тонколистового металу. Всередині корпусу встановлена робоча камера, в нижній частині якої закріплені два нагрівальних елементи. Простір між корпусом і камерою заповнений теплоізоляційними прокладками, зробленими з гофрованого картону. Корпус закривається металевими дверцятами.
Металеві дверцята зроблені у вигляді двохстінної коробки з тонколистового металу. Простір між двома стінками заповнений ізоляційними прокладками. По периметру дверцят укріплена гумова магнітна прокладка для ущільнення між дверцятами і корпусом термостата.
На дверцятах і корпусі є два гвинти з отворами для проволоки, на яку вішають пломбу.
Прозорі дверцята дають змогу спостерігати за процесом у робочій камері, не відкриваючи їх і не порушуючи температурний режим.
Прозорі дверцята по периметру обклеєні прокладкою з гуми для ущільнення між дверцятами і робочою камерою.
Робоча камера має прямокутну форму, її стінки виготовлені з латуні. У верхній частині камери встановлено датчик температури. Для усунення місцевого перегрівання бічні стінки і дно камери обклеєні азбестовим папером. Температурний режим у робочій камері контролюється термометром, який встановлюється через отвір, що розміщений у блоці керування. Всередині камери встановлено металеві полички з отворами для полегшення циркуляції повітря.
Блок керування призначений для автоматичного регулювання та підтримання температури в робочій камері. На панелі блоку керування встановлено тумблер, запобіжники, кнопковий замикач, сигнальну лампу включення в електромережу і одночасно для підсвічування шкали термометра; сигнальну лампу включення нагрівальних елементів термостата, ручки резисторів для встановлення температурного режиму.
Алгоритм "Підготовка термостата до роботи":
— перевірте, чи заземлений термостат;
— підключіть апарат до електромережі, поверніть тумблер у бік напису "мережа" (рос. мовою — "сеть") — сигнальна лампочка світиться у напівнакалі;
— поверніть ручку резистора, встановіть потрібну температуру;
— відкрийте дверцята;
— поставте чашки Петрі в робочу камеру термостата догори дном;
Увага! Чашки Петрі розміщують на поличках і дні робочої камери гіркою оптимально не більше ніж по 5 штук, нещільно, що забезпечує циркуляцію повітря і рівномірне нагрівання всіх чашок. Чашки обов'язково ставлять догори дном. Це забезпечує добру аерацію чашок і запобігає потраплянню конденсаційної води з кришки чашки на посів, яка перешкоджає утворенню ізольованих колоній.
— закрийте прозорі дверцята;
— закрийте металеві дверцята.
Для успішного культивування мікроорганізмів у лабораторних чи промислових умовах потрібно правильно підібрати поживні середовища, правильно виконати посів і створити належні умови для культивування: оптимальну температуру, відсутність світла, вологість, аерацію або відсутність повітря (кисню), витримати певний термін культивування.
Оптимальну температуру створюють у термостаті. Більшість патогенних мікробів ростуть за температури 37 °С.
Для більшості мікроорганізмів, у тому числі і патогенних, світло не потрібне, тому їх культивують у темряві (термостат має непрозорі стінки). Вологість — неодмінна умова розвитку мікроорганізмів, тому їх краще висівати на свіжовиготовлені середовища.
Аерація необхідна для культивування облігатних аеробів і факультативних анаеробів. У пробірки кисень разом із повітрям проникає через ватно-марлеві пробки, у чашки Петрі — через щілину між кришкою і дном чашки.
Облігатні анаероби культивують в умовах повної відсутності кисню в поживних середовищах і навколишньому просторі. Для цього використовують різні методи для видалення кисню із середовища і запобігання насиченню середовища киснем. В умовах лабораторії рідкі поживні середовища регенерують — кип'ятять для видалення кисню, різко охолоджують, засівають і заливають на висоту 1 см стерильним вазеліновим маслом або роблять посів уколом у високий стовпчик агару, інколи агаром з посівом заповнюють трубки і запаюють їх на кінцях. Анаеробні умови можна створити в анаеростаті, де культивують мікроби у вакуумі або атмосфері іншого газу (азоту, пропану тощо), а також в ексикаторі. З повітря, що міститься в ексикаторі, кисень поглинають хімічні речовини або запалена свічка.
Деякі мікроорганізми краще культивуються в атмосфері, що містить 5—10 % вуглекислого газу. Це капнофільні мікроорганізми (бруцели, менінгококи).
Термін культивування для різних мікробів різний. Більшість патогенних мікробів культивують протягом 18—24 год, але деякі ростуть повільніше: бордетели — 3—4 доби, спірохети — 7—12 днів, мікобактерії туберкульозу — до 3 міс.
4. Етапи виділення чистої культури мікроорганізмів. Ідентифікація чистих культур мікроорганізмів
Завдання 9. Вивчіть принципи виділення та ідентифікації чистої культури мікроорганізмів.
В організмі людей, тварин, у навколишньому середовищі патогенні мікроорганізми змішані з умовно-патогенними та сапрофітами, тому виділення чистої культури мікроорганізмів є обов'язковим етапом бактеріологічного (культурального) дослідження. Це дає змогу ідентифікувати її за певними властивостями.
На щільних поживних середовищах мікроорганізми утворюють колонії. Вважають, що колонія — це видиме скупчення мікроорганізмів, які виросли з однієї клітини, тому чисту культуру виділяють шляхом посіву матеріалу з однієї ізольованої колонії. Виділення чистої культури та її ідентифікацію проводять у декілька етапів:
1-й етап — посів патологічного матеріалу на поживні середовища з метою отримання ізольованих колоній (вибір методу культивування, склад поживного середовища залежить від типу живлення і дихання мікроорганізмів);
2-й етап — визначення характеру росту мікроорганізмів на поживних середовищах (культуральних властивостей), відбір характерних колоній;
3-й етап — визначення морфології і тинкторіальних властивостей мікроорганізмів;
4-й етап — пересівання підозрілих колоній з метою виділення чистої культури мікробів;
5-й етап — перевірка чистоти виділеної культури;
6-й етап — визначення ферментативних властивостей мікроорганізмів;
7-й етап — визначення точних маркерів мікроорганізмів: антигенної структури, фагочутливості, коліциногенності, ан-тибіотикограми тощо.
Характер росту мікроорганізмів на поживному середовищі визначає їх культуральні властивості. Ці властивості постійні для кожного виду мікроорганізмів, тому є важливою ознакою під час їх ідентифікації.
У рідких поживних середовищах мікроорганізми можуть утворювати помутніння, осад, плівку, пристінковий ріст.
На щільних поживних середовищах вивчають колонії неозброєним оком, через лупу або під мікроскопом, результати відмічають у робочому журналі. Характеризують колонії за розміром, формою, контуром краю, прозорістю, рельєфом, характером поверхні, кольором, структурою, консистенцією.
За розміром колонії бувають: точкові (діаметр менший ніж 1 мм), дрібні (діаметр 1—2 мм), середнього розміру (діаметр 2—4 мм), великі (діаметр 4—6 мм і більше).
Форма колоній буває: правильна — кругла, неправильна — амебоподібна, ризоїдна (нагадує переплетене коріння дерева).
Контур краю визначають неозброєним оком або під мікроскопом. Він може бути рівний і нерівний. Нерівний край буває: фестончастий — утворює великі заокруглені зубці правильної форми; хвилястий — великі заокруглені зубці виражені нечітко; зазубрений — зубці гострі, різної величини і форми; бахромчастий — має ніжні ворсинки; розпливчастий — важко відрізнити межу між колонією і поживним середовищем.
За прозорістю колонії бувають: прозорі, напівпрозорі, непрозорі, прозорі або напівпрозорі з непрозорим центром.
Рельєф колоній вивчають неозброєним оком або через лупу, розглядаючи колонію згори і збоку. За рельєфом колонії бувають: каплеподібні і куполоподібні — мають правильну округлу форму у вигляді сегмента кулі, можуть бути слабовипуклі і випуклі; плосковипуклі — випуклі з плоскою верхівкою, у вертикальному розрізі нагадують трапецію; конусоподібні — у вертикальному розрізі нагадують трикутник; плоскі або випуклі з центром у вигляді сосочка; випуклі з вдавленим центром; плоскі — розстилаються по поверхні середовища.
Поверхня буває матовою або блискучою, сухою або вологою, гладенькою або шорсткою. Колонії з гладенькою поверхнею позначають буквою S (від англ. smooth — гладенький), з шорсткою — буквою R (від англ. rough — шорсткий).
Колір колоній зумовлений пігментом, який продукує культура мікроорганізмів. Переважна більшість патогенних мікробів не утворюють пігмент, тому їх колонії безбарвні, у проникаючому світлі вони прозорі, напівпрозорі або непрозорі. Колонії пігментоутворюючих мікроорганізмів мають різний колір: жовтий, оранжевий, червоний, чорний, фіолетовий тощо. Так, си-ньогнійна паличка утворює колонії синьо-зеленого кольору, а стафілококи — білого і жовтого.
Структура колоній визначається під мікроскопом. У непрозорих колоній вона не визначається. За структурою розрізняють такі види колоній: гіалінові — без видимої певної структури; зернисті — залежно від розміру зерен можуть бути дрібно- і грубозернистими; волокнисті — наявність волокон усередині колонії.
Колонії також можуть бути однорідні і неоднорідні. В однорідних будова колонії у всіх її частинах однакова, у неоднорідних центральна частина або сектор відрізняється від іншої частини колонії.
Консистенція — це фізичний стан колонії. її визначають за допомогою бактеріологічної петлі. За консистенцією колонії бувають: пастоподібні (нагадують вершкове масло), легко знімаються; в'язкі або слизькі, прилипають і тягнуться за петлею; волокнисті, шкірясті, щільні — знімаються з поверхні поживного середовища у вигляді плівки, відповідно до розміру і форми колонії; крихкі, сухі — розсипаються у разі торкання петлею.
Завдання 10. Визначте й опишіть культуральні властивості бактерій на поживному середовищі Ендо.
Алгоритм "Визначення культуральних властивостей мікроорганізмів на пластинчастих середовищах":
— візьміть чашку Петрі у ліву руку, тримайте її проти джерела світла на рівні очей дном до себе;
— відмітьте маркером ізольовану колонію;
— опишіть ознаки цієї колонії;
— визначте у проникаючому світлі розмір, форму колонії, контур краю, прозорість;
— покладіть чашку Петрі на ліву руку дном донизу;
— розгляньте колонію у відбитому світлі, визначте рельєф, характер поверхні, колір;
— покладіть чашку на предметний столик мікроскопа догори дном, встановіть об'єктив х8, опустіть конденсор, визначте структуру колонії;
— визначте консистенцію колонії, торкнувшись до неї бактеріологічною петлею.
Увага! Консистенцію колонії найчастіше визначають під час виготовлення мазка або пересіванні культури.
Завдання 11. Вивчіть способи виявлення ферментативної активності мікроорганізмів.
Здатність виробляти ферменти (ферментативна активність) у мікроорганізмів кодується генами і є їх постійною індивідуальною ознакою. За ферментативною активністю відрізняються не тільки окремі види мікробів, а й окремі варіанти одного виду. Вони називаються біоварами. Тому вивчення ферментативної активності мікроорганізмів є важливим етапом ідентифікації культури. Ферментативна активність мікробів багата і різноманітна, але в лабораторній практиці враховують не всі ферменти, що виробляють мікроби, а тільки ті, за якими можна диференціювати генетично близькі між собою види. Найчастіше вивчають ферменти, здатні розщеплювати вуглеводи (сахаролітичні), білки (протеолітичні), сечовину (уреазу), розщеплювати лецитин (лецитиназу), ферменти, що зумовлюють окисно-відновні властивості мікробів (дегідрази, каталазу, оксидазу), а також токсини, що руйнують еритроцити (гемолітичні властивості).
Сахаролітичну активність виявляють на поживних середовищах, що містять певний вуглевод чи багатоатомний спирт (у мікробіологічній практиці вуглеводи і багатоатомні спирти об'єднують в одну групу). Під впливом сахаролітичних ферментів вуглеводи розщеплюються до кислоти і газу (СОа, Н2, СН4). Для виявлення кислот до поживних середовищ додають індикатор. Накопичення газу виявляють у напіврідкому середовищі за появою кульок газу в середовищі, розривом середовища, піноутворенням. Цей принцип покладено в основу використання диференціально-діагностичних середовищ Ресселя, Гісса, Ендо, ЕМС та ін.
На середовищі з крохмалем визначають здатність мікроорганізмів продукувати фермент амілазу, що супроводжується гідролізом крохмалю, — у разі додавання розчину Люголю до засіяного середовища реакція на крохмаль стає негативною (тобто під дією йоду середовище не синіє).
На середовищі з молоком визначають здатність мікроорганізмів продукувати фермент лактазу, що розщеплює молочний цукор лактозу до кислоти або до кислоти і газу. При цьому молоко зсідається, утворюється казеїн (зсілий білок молока).
Протеолітичну активність мікроорганізмів визначають на середовищах, що містять желатин, молоко, сироватку крові, білок курячого яйця, шматочки вареного м'яса, пептон.
Для виявлення ферменту желатинази мікроби засівають уколом на поживне середовище (м'ясопептонний желатин), ін-кубують за температури 22 °С або 37 °С протягом від 1 до 20 діб. Характер розрідження желатину, спричинений різними мікробами, різний. Так, холерний вібріон зумовлює розрідження желатину у вигляді лійки (суцільне розрідження), збудник сибірки — у вигляді перевернутої ялинки (розрідження шарами).
У середовищі з молоком мікроорганізми, які утворюють протеолітичні ферменти, пептонізують казеїн. Тому рідке молочне середовище стає напівпрозорим, має вигляд молочної сироватки.
Протеолітично активні мікроби гідролізують білки до індолу, сірководню, аміаку. Індол утворюється внаслідок розщеплення амінокислоти триптофан. Для виявлення індоло-утворення у пробірку із середовищем, в яке засіяна культура досліджуваних мікроорганізмів, вносять індикаторну паперову смужку, просякнуту розчином щавелевої кислоти. Під дією індолу смужка паперу набуває блідо-рожевого кольору. Сірководень можна визначити за допомогою індикаторної паперової смужки, просякнутої розчином свинцю ацетату. Під дією сірководню утворюється свинцю сульфід — речовина чорного кольору, внаслідок чого папірець також набуває чорного кольору.
Гемолітичні властивості мікробів, тобто здатність руйнувати еритроцити, визначають на поживних середовищах із кров'ю. Розрізняють два види гемолізу: альфа- і бета-гемоліз. Якщо мікроорганізми спричинюють альфа-гемоліз, то на кров'яному агарі навколо колоній утворюється зелена зона (часто в такий самий колір забарвлюється і колонія) внаслідок перетворення гемоглобіну на метгемоглобін. У разі бета-гемолізу утворюється прозора зона навколо колонії.
Лецитиназну активність, здатність руйнувати лецитин у мембранах клітин визначають на середовищах із жовтком курячого яйця. Якщо мікроорганізми утворюють фермент леци-тиназу, навколо колоній утворюється райдужний вінчик.
Фермент плазмокоагулазу вивчають на середовищі, що містить цитратну плазму крові. Через 2—3 год культивування в термостаті за температури 37 °С плазма зсідається (не виливається з перевернутої пробірки).
Уреазну активність визначають на середовищах, що містять сечовину. Оскільки уреаза розщеплює сечовину до вуглекислого газу й аміаку (вуглекислий газ погано розчиняється у воді, а аміак — дуже добре), середовище набуває лужної реакції, на що вказує зміна кольору індикатора.
Завдання 12. Визначте ферментативну активність мікробів на середовищах Гісса, МПБ, кров'яному агарі та ЖСА.
Алгоритм "Визначення сахаролітичних властивостей мікроорганізмів на середовищах Гісса":
— порівняйте за кольором контрольні (без росту культури)
і дослідні (з ростом культури) пробірки із середовища
Гісса;
зверніть увагу, в якій пробірці змінився колір середовища, зробіть висновок про те, які вуглеводи розщеплює культура мікроорганізмів; зверніть увагу на наявність кульок газу.
Примітка. В напіврідких середовищах Гісса визначають також рухливість мікроорганізмів. Нерухливі форми мікробів ростуть тільки вздовж уколу, який має циліндричну або конусоподібну форму, середовище залишається прозорим. Рухливі мікроби спричинюють рівномірне помутніння всього середовища.
Визначення протеолітичних властивостей проводять у середовищі МПБ з індикаторними папірцями.
Зверніть увагу на колір паперових смужок, зробіть висновок про утворення культурою мікробів індолу й сірководню.
Огляньте чашку Петрі із середовищем КА у прямому світлі, відмітьте наявність зони гемолізу, її колір.
Огляньте чашку Петрі із середовищем ЖСА у відбитому світлі, похитайте її, зверніть увагу на наявність зони лецитина-зи (райдужного вінчика) навколо колоній. У разі рясного росту патогенного стафілокока окремі зони лецитинази зливаються у суцільну зону.
Для біохімічної ідентифікації мікроорганізмів у медичній практиці використовують прискорені методи — мікротест-системи (АРІ, Міпіїек, Епіегоіеві; тощо). Вони дають змогу швидко ідентифікувати культуру мікроорганізмів і визначити її антибіотикограму.
Контрольні запитання
1. У якому вигляді випускають сухі поживні середовища?
2. Які дані про поживне середовище наведені на етикетці?
3. Який матеріал використовують для посіву на поживні середовища?
4. Яких правил посіву слід дотримуватися, щоб отримати ізольовані колонії?
5. Яких правил слід дотримуватися під час посіву живої культури?
6. Як підписати чашку Петрі після посіву?
7. Яка техніка посіву патологічного матеріалу петлею (на щільне і рідке поживне середовище), тампоном, шпателем?
8. Як забезпечити необхідні умови культивування аеробних і анаеробних мікроорганізмів?
9. Як правильно розмістити чашки Петрі в термостаті?
10. З якою метою визначають ферментативну активність мікроорганізмів?
11. Які групи ферментів враховують під час визначення ферментативної активності?
12. На яких середовищах і як визначають сахаролітичні ферменти мікроорганізмів?
13. На яких середовищах і як визначають протеолітичні ферменти мікроорганізмів?
14. Як визначають гемолітичну властивість мікроорганізмів? Які бувають види гемолізу?
15. Як визначають лецитиназну активність мікроорганізмів?
Тести
1. Номер аналізу підписують:
а) на кришці чашки Петрі;
б) на дні чашки Петрі;
б) на дні чашки Петрі;
в) не має значення.
2. Чашки Петрі з посівом ставлять у термостат:
а) догори кришкою;
б) догори дном;
в) не має значення.
3. Мікроби, що обов'язково ростуть за наявності кисню:
а) мікроаерофіли;
б) облігатні анаероби;
в) облігатні аероби;
г) факультативні аероби.
4. Фактор, що не потрібен для культивування мікробів:
а) оптимальна температура;
б) вологість;
в) повітря;
г) світло.
5. Середовища, найбільш сприятливі для певного виду мікробів:
а) спеціальні;
б) елективні;
в) селективні;
г) основні.
6. Ферменти, що розщеплюють білки:
а) протеолітичні;
б) сахаролітичні;
в) уреаза;
г) гіалуронідаза.
Ситуаційні задачі
1. У поживне середовище з молоком висіяли культуру мікроорганізмів. Через деякий час середовище стало напівпрозорим. Що стало причиною зміни вигляду середовища?
2. Після посіву харчових продуктів, підозрілих щодо харчового отруєння, у поживному середовищі з молоком через 4 год утворився пухкий згусток казеїну, а пробки повилітали з пробірок. На які властивості бактерій вказують ці факти?
3. Після посіву мокротиння хворого на пневмонію на поживне середовище з кров'ю виросли дрібні, вологі, зеленкуваті колонії, навколо яких середовище позеленіло. Дайте пояснення цьому явищу.
4. Через добу після посіву на середовище Гісса з лактозою було виявлено, що бактерії виросли вздовж уколу, середовище залишилося прозорим і колір його не змінився. Як оцінити цей результат?
5. Під час зняття пов'язки з гнійної рани було відмічено, що бинти набули синьо-зеленого кольору і запаху суничного мила. Чи можна орієнтовно зробити висновок про те, які бактерії спричинили загнивання рани?
Домашнє завдання
Підготуйтесь до практичного заняття 4.
Рекомендації щодо самопідготовки до практичного
заняття 4
1. Ознайомтеся з темою і метою практичного заняття, запишіть у щоденнику тему і план заняття.
2. Вивчіть теоретичний матеріал (див. підручник, с. 57—77; практикум, с. 56—66).
Практичне заняття 4 ДЕЗІНФЕКЦІЯ. СТЕРИЛІЗАЦІЯ
Мета заняття:
— знати способи стерилізації та дезінфекції;
— уміти підготувати матеріал до стерилізації;
— уміти проводити дезінфекцію рук, робочого місця, патологічного матеріалу.
Оснащення: апаратура для стерилізації: стерилізатор паровий (автоклав), сухожарова шафа, інактиватор, апарат для зсідання й інактивації сироватки; тести для перевірки якості роботи стерилізаторів: максимальний і немаксимальний ртутні термометри, хімічні тести, біологічні тести, індикатори стерилізації; пінцет, вата, дезінфекційні засоби: 0,1 % розчин дезак-тину, стериліум.
План
1. Поняття про асептику та антисептику.
2. Дезінфекція.
3. Стерилізація. Методи стерилізації медичного інструментарію, перев'язувального матеріалу, лабораторного посуду, поживних середовищ. Контроль якості роботи стерилізаторів і якості стерилізації.
4. Проведення дезінфекції піпеток, рук, робочого місця, патологічного матеріалу.
Хід заняття 1. Поняття про асептику та антисептику
Хімічні речовини, які згубно діють на мікроорганізми, але не впливають негативно на макроорганізм, та які застосовують для лікування інфекційних хвороб, називають антисептиками.
^Днтисептика — це комплекс заходів, спрямованих на знищення мікроорганізмів або пригнічення їх росту на об'єкті
(рана, організм). З цією метою застосовують бактерицидні хімічні речовини.
Асептика — система профілактичних заходів (дезінфекція, стерилізація), спрямована на запобігання мікробному забрудненню рани, операційного поля, культури мікроорганізмів та ін.
Для проведення дезінфекції і стерилізації використовують різні методи залежно від того, який режим стерилізації вони забезпечують.
2. Дезінфекція
Завдання 1. Ознайомтеся з основними видами дезінфекції.
Дезінфекція — це повне знищення вегетативних і спорових форм патогенних та умовно-патогенних мікроорганізмів у навколишньому середовищі (у приміщенні: підлога, стіни, ручки дверей; на поверхні меблів, апаратів, приладів; на посуді, білизні; у патологічному матеріалі, отриманому від хворих, тощо).
Таблиця 2. Методи дезінфекції
| Метод дезінфекції | Принцип методу |
| Механічний | Миття рукз милом, вологе прибирання приміщення, прання білизни, провітрювання приміщення тощо |
| Фізичний | Кип'ятіння, спалювання, оброблення парою, ультрафіолетове опромінювання |
| Хімічний | Оброблення хімічними засобами (антисептиками та дезінфектантами) |
Метою дезінфекції є запобігання передачі збудників від інфікованого організму до неінфікованого через об'єкти навколишнього середовища. Методи проведення дезінфекції наведено у табл. 2.
Дезінфекція буває поточною і заключною. Поточну дезінфекцію проводять багаторазово протягом дня в лікувально-профілактичних та інших закладах. Заключну проводять одноразово наприкінці робочого дня, або в осередку інфекції після госпіталізації хворого, переведення хворого в іншу палату, або після смерті пацієнта.
Для дезінфекції використовують багато (понад 250) різних хімічних препаратів. Більшість із них випускають готовими для використання у вигляді концентрованої рідини, розчинів, таблеток, емульсій, суспензій, аерозолів.
Дезінфекційні засоби, зареєстровані в Україні, застосовують відповідно до режимів, які регламентовані методичними вказівками і в установленому порядку затверджені головним державним санітарним лікарем України. Останнім часом в Україні зареєстровані ефективні дезінфекційні препарати для проведення поточної і заключної дезінфекції: МедіДес, Тетралін, КвікДес, Сентамін та ін. їх можна використовувати для знезараження поверхні приміщень, твердих меблів, медичних приладів і апаратури, предметів догляду за хворими, лабораторного посуду, забрудненого виділеннями хворих, білизни, прибирального інвентарю, а також кухонного посуду.
Для гігієнічного оброблення шкіри рук медичного персоналу рекомендовано препарати БактеріоСол, Октенісепт, Стериліум та ін.
Дезінфекційні засоби можуть негативно впливати на макроорганізм, тому під час виготовлення дезінфекційних розчинів слід дотримуватися правил техніки безпеки (працювати в гумових рукавичках, герметичних окулярах, надягати чотиришарову марлеву пов'язку).
3. Стерилізація. Методи стерилізації медичного інструментарію, перев'язувального матеріалу, лабораторного посуду, поживних середовищ. Контроль якості роботи стерилізаторів і якості стерилізації
Завдання 2. Ознайомтеся з методами стерилізації медичного інструментарію, перев'язувального матеріалу, лабораторного посуду, поживних середовищ.
Стерилізація — це повне знезараження об'єктів навколишнього середовища (знищення вегетативних і спорових форм мікробів).
Стерилізація дає змогу запобігти занесенню мікробів в організм людини під час медичних втручань; обсіменінню сторонньою мікрофлорою патологічного матеріалу, культур мікроорганізмів, які досліджують, а також поживних середовищ, лікарських і діагностичних препаратів. Способи стерилізації подані на схемі 1.
Фізичний спосіб. Застосовують термічну, механічну та променеву стерилізацію. Термічні способи стерилізації наведено у табл. 3.
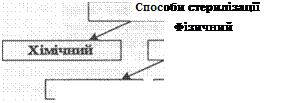
| Термічний Механічний Променевий |
Біологічний