
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Принципы формирования электронной структуры атомов
|
|
|
|
Конфигурация электронной оболочки невозбужденного атома определяется зарядом его ядра.
Электронная конфигурация химического элемента - это запись распределения электронов в атоме по квантовым слоям (оболочкам), подслоям (подоболочкам) и орбиталям. Обычно электронная конфигурация приводится для основного состояния атома. При записи электронной конфигурации указывают цифрами главное квантовое число (n), буквами- подслои (подоболочки) (s, p, d, f), а степень буквенных обозначений подслоев обозначает число электронов в данном слое. Например, электронная конфигурация лития- 1s2 2s1.
При составлении электронных конфигураций многоэлектронных атомов учитывают принцип Паули,принцип минимальной энергии, правила Клечковского, правило Хунда.
Принцип Паули: в атоме не может быть двух электронов, имеющих
одинаковый набор всех четырех квантовых чисел.
Из принципа Паули вытекает, что на одной орбитали может находиться лишь два электрона - с ms= +l/2 и -1/2.Так электронные конфигурации атома водорода и следующего после водорода элемента - гелия имеют вид:
I период
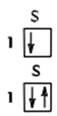
H(Z=1) 1S1
He(Z=2) 1S2
Следовательно, в s-состоянии (одна орбиталь) может быть только два электрона, в р-состоянии (три орбитали) - шесть, в d-состоянии (пять орбиталей) -десять, в f-состоянии (семь орбиталей) - четырнадцать электронов.
Принцип минимальной энергии: электроны в основном состоянии заполняют орбитали в порядке возрастания энергии орбиталей.
Правила B. M. Клечковского: 1) электрон обладает наинизшей энергией на том энергетическом подуровне, где сумма квантовых чисел n и 1 минимальна (Е = min при n+1= min);
2) если сумма квантовых чисел n и 1 одинакова для рассматриваемых энергетических подуровней, то электрон обладает наинизшей энергией на подуровне с наименьшим значением главного квантового числа (Е = min при n = min, если n + 1 = const) Правила В.M. Клечковского начинают действовать с 4 периода периодической таблицы Д.И. Менделеева.
Рассмотрим правила Клечковского при составлении схем электронного строения для атомов некоторых химических элементов 4 периода.
K (Z = 19) KL3s23p64s1 3d 4s
n+1=3+2=5 n+1=4+0=4
Ca (Z = 20) KL 3s23p64s2
Sc (Z = 21) KL 3s23p64s23d1
Zn (Z = 30) KL3s23p64s23d1 0 KLM 4s2
Соответственно принципу минимальной энергии и правилам
Клечковского заполнение энергетических подуровней происходит в
следующем порядке:
1s<2s<2p<3s<3p<4s»3d<4p<5s»4d<5p<6s»5d»4f<6p<7s<5f»6d<7p
Исключение составляют d- и f-элементы с полностью и наполовину заполненными подуровнями, у которых наблюдается так называемый провал электронов, например, Cr, Cu, Ag, Mo, Pd, Pt.
Правило Хунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня (подслоя), при котором абсолютное значение суммарного спина атома максимально.
Иными словами, орбитали данного подслоя заполняются сначала по одному, затем по второму электрону. Электроны с противоположными спинами на одной орбитали образуют двухэлектронное облако,и их суммарный спин равен нулю.
Рассмотрим правило Хунда при составлении схем электронного строения для атомов следующих химических элементов:
C(Z=6) 1s22s22p2 C*1s22s12p3

С Sms =0 Sms=2 Sms =1
При возбуждении атома углерода, т.е. затрате некоторой энергии, один из имеющихся в атоме 2s-электронов переходит на подуровень 2р; в результате атом переходит в возбужденное состояние,а число неспаренных электронов возрастает. В устойчивом состоянии атом углерода может участвовать в образовании двух ковалентных связей (валентность равна 2),
в возбужденном состоянии - в образовании четырех ковалентных связей(валентность равна 4).
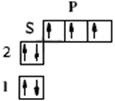
| n=2 |
N (Z=7) 1s22s22p3
| О(Z=8) 1s22s22p4 | 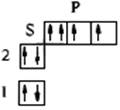
|
| Ne (Z=10) 1s22s22p6 | 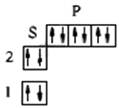
|
| n=3 |
| Ar (Z=18) KL3s23p6 | 
|
6. Периодическая система Д.И. Менделеева как естественная классификация элементов по электронному строению.
|
|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 1457; Нарушение авторских прав?; Мы поможем в написании вашей работы!