
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Силы межмолекулярного взаимодействия
|
|
|
|
Основные виды межмолекулярного взаимодействия.
Металлическая связь
Атомы металлов на внешнем энергетическом уровне содержат малое число электронов и обладают большим радиусом. Поэтому они легко отдают наружные электроны и превращаются в положительно заряженные ионы. Оторвавшись от атомов, электроны перемещаются между положительно заряженными ионами металлов, находящихся в узлах кристаллической решетки. Таким образом, металл можно рассматривать как плотно упакованную структуру из положительно заряженных ионов, связанных друг с другом коллективизированными электронами (электронным газом).
Металлическая связь - это связь между положительно заряженными ионами металлов и делокализованными электронами, принадлежащими всему объему металлического кристалла.
В чистом виде металлическая связь проявляется только для металлов I, II групп, т.к. количество валентных электронов и электронов проводимости у них одно и тоже.
Для металлов III - VIIIгрупп связь в кристаллических решетках будет смешанной (ковалентно - металлической или ковалентно – ионно - металлической).
Между молекулами может осуществляться как электростатическое так и донорно - акцепторное взаимодействие.
Силы межмолекулярного взаимодействия, возникающие без передачи атомами электронов, носят название ван-дер-ваальсовых сил.
Изучение электростатического межмолекулярного взаимодействия имеет большое значение для исследования свойств и структуры газов, жидкостей и твердых веществ. Ван-дер-ваальсовы силы обусловливают притяжение молекул и агрегацию вещества, превращение газообразного вещества в жидкое и далее в твердое состояние.
По сравнению с ковалентной связью ван-дер-ваальсово взаимодействие очень слабо.
Ван-дер-ваальсово взаимодействие молекул рассматривается, как результат трёх эффектов: ориентационного, индукционного и дисперсионного.
Наиболее универсально (т.е. проявляется в любых случаях) дисперсионное, так как оно обусловлено взаимодействием молекул друг с другом за счет их мгновенных микродиполей (рис. 15а). При сближении молекул ориентация микродиполей перестает быть независимой, и их появление и исчезновение в разных молекулах происходит в такт друг другу. Синхронное появление и исчезновение микродиполей разных молекул сопровождается их притяжением. При отсутствии синхронности в появлении и исчезновении микродиполей происходит отталкивание.
Ориентационное (диполь-дипольное) взаимодействие проявляется между полярными молекулами (рис. 15б), В результате беспорядочного теплового движения молекул при их сближении друг с другом одноименно заряженные концы диполей взаимно отталкиваются, а противоположно заряженные притягиваются. Чем более полярны молекулы, тем сильнее они притягиваются и тем самым больше ориентационное взаимодействие.
Индукционное взаимодействие молекул осуществляется за счет их индуцированных диполей (рис. 15в). Допустим, что встречаются полярная и неполярная молекулы. Под действием полярной молекулы неполярная молекула деформируется и в ней возникает (индуцируется) диполь. Индуцированный диполь притягивается к постоянному диполю полярной молекулы и в свою очередь усиливает электрический момент диполя полярной молекулы.
Индукционное взаимодействие тем больше, чем больше момент диполя и поляризуемость молекулы.
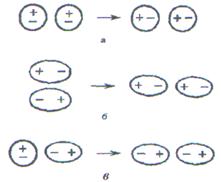
Рис. 16. Ван-дер-ваальсовы взаимодействия молекул: а - дисперсионное; б - ориентационное (диполь - дипольное); в - индукционное.
|
|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 1240; Нарушение авторских прав?; Мы поможем в написании вашей работы!