
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическая кинетика
|
|
|
|
S = R ln W (11),
Факторы, определяющие глубину и направленность химических реакций. Понятие об энтропии и энергии Гиббса. Второй и третий законы термодинамики.
Энтропия S является функцией состояния и определяет меру беспорядка, неупорядочности в системе. Чем выше неупорядочность в системе, тем больше энтропия.
В отличие от других термодинамических функций, можно определить не только изменение, но и абсолютное значение энтропии. Это вытекает из постулата М. Планка (1911 г.), который получил название третьего закона термодинамики: при абсолютном нуле (Т=0 К) энтропия идеального кристалла равна нулю.
Состояние системы можно характеризовать микросостояниями составляющих её частиц, т.е. их мгновенными координатами и скоростями различных видов движения в различных направлениях. Число микросостояний системы называется термодинамической вероятностью системы W.
Энтропия системы S, отнесённая к одному молю вещества, определяется по уравнению Больцмана:
где R – молярная постоянная.
Из уравнения (11) следует, чем больше число степеней свободы у частиц в системе, тем выше энтропия системы.
Все изменения в системе, которые приводят к увеличению беспорядка в системе, (плавление, испарение, растворение, реакции, идущие с увеличением объёма, нагревание) приводят к росту энтропии (DS > 0).И, наоборот, процессы, связанные с увеличением порядка в относительном расположении частиц (охлаждение, конденсация, кристаллизация, сжатие) приводят к уменьшению энтропии (DS < 0).
Энтропия имеет единицу измерения: Дж / (моль × К).
Энтропию, как и тепловые эффекты, принято относить к стандартным условиям.
Энтропия вещества в стандартном состоянии называется стандартной энтропией So.
В справочниках обычно приводится стандартная энтропия  при 298 К.
при 298 К.
Значениями энтропии веществ пользуются для установления изменения энтропии системы в результате соответствующих процессов. Так, для химической реакции изменение энтропии системы будет:
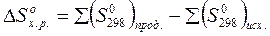 (12)
(12)
Второй закон термодинамики: в изолированных системах самопроизвольно идут только такие процессы, которые сопровождаются возрастанием энтропии (DS > 0).
Таким образом, условием самопроизвольного протекания процесса является условие: DS > 0.Если DS < 0,то процесс самопроизвольно не протекает.Для состояния равновесия обратимых реакций - DS = 0.
Для фазового превращения энтропию можно вычислить по формуле:
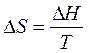 (13)
(13)
Например, для процесса плавления:
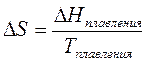
Энергия Гиббса или изобарно–изотермический потенциал G (p,T=const) является критерием самопроизвольного протекания химических реакций.
В химических процессах одновременно действуют две тенденции: стремление частиц к порядку, к объединению за счёт прочных связей в более сложные, что уменьшает энтальпию системы (энтальпийный фактор DН ), и стремление частиц к беспорядку, к разъединению, что увеличивает энтропию системы (энтропийный фактор TDS ).
Суммарный эффект этих двух противоположных тенденций в химических процессах, протекающих при постоянных T и p, отражает изменение энергии Гиббса G:
DG = DH – TDS (14)
Изменение энергии Гиббса системы при образовании 1 моль вещества из простых веществ при стандартных условиях называется стандартной энергией Гиббса
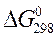 (кДж/моль).
(кДж/моль).
Стандартная энергия Гиббса образования простого вещества, устойчивого в стандартных условиях, равна нулю.
Изменение энергии Гиббса, как и изменение энтальпии и энтропии системы, не зависит от пути процесса. Поэтому для химической реакции DGопределяется по формуле:
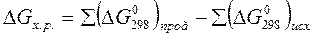 (15)
(15)
С энергией Гиббса связана формулировка второго закона термодинамики: всякий самопроизвольно идущий процесс при условии p,T=const протекает в том направлении, при котором происходит в системе уменьшение энергии Гиббса, т.е. DG<0.
Иными словами, самопроизвольно протекают реакции, если энергия Гиббса в исходном состоянии системы больше, чем в конечном.
Увеличение энергии Гиббса, т.е. DG>0, свидетельствует о невозможности самопроизвольного осуществления процесса в данных условиях.
Если же DG=0, система находится в состоянии химического равновесия.
Влияние температуры на направление химических реакций представлено в таблице 4.
Согласно уравнению (14) влияние температуры на DGопределяется знаком и величиной DS.
При нормальных температурах и незначительном изменении DS:
DG = DH,
т.к. член уравнения (14) TDS @ 0.
Но химическая реакция возможна только при DG <0, т.е. при DG = -DH.
Следовательно, при нормальных температурах и незначительном изменении DSсамопроизвольно могут протекать только экзотермические реакции (DH < 0).
Если в результате экзотермической реакции уменьшается число молей газообразных веществ и, соответственно, энтропия системы (DS < 0),то при низких температурах |DH| > |TDS|, и реакция может самопроизвольно протекать в прямом направлении (DG < 0).
Эндотермические реакции при невысоких температурах могут протекать в прямом направлении только вынужденно, т.е. при изменении параметров системы.
При высоких температурах |TDS|будет определять направление химической реакции, и в зависимости от значения температуры может меняться как значение, так и знак DG.
Для определения температуры, выше которой происходит смена знака энергии Гиббса реакции, можно воспользоваться условием равновесия:
DG = 0;
т.е.
DH = Tp DS (16),
откуда
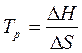 (17),
(17),
где  - температура, при которой устанавливается равновесие, т.е. равновероятная возможность протекания прямой и обратной реакции.
- температура, при которой устанавливается равновесие, т.е. равновероятная возможность протекания прямой и обратной реакции.
Таблица 4. Влияние температуры на направление химических реакций.
| DH | DS | DG | Направление реакции | Примеры реакций |
| DH < 0 | DS > 0 | DG < 0 | Прямая реакция может быть самопроизвольной при любых температурах |
С(графит) + O2 = CO O2 = CO
|
| DH > 0 | DS < 0 | DG > 0 | Прямая реакция не может протекать само-произвольно при любых температурах | CO = С(графит) + O2 O2
|
| DH < 0 | DS < 0 | DG < 0 при Т < Тр DG > 0 при Т > Тр | Самопроизвольно может протекать прямая реакция при низких температурах и обратная реакция – при высоких темпера-турах | CaO + CO2 = CaCO3 |
| DH > 0 | DS > 0 | DG > 0 при Т < Тр DG < 0 при Т > Тр | Самопроизвольно может протекать прямая реакция при высоких температурах и обратная реакция – при низких темпера-турах | CH4 + 2H2O(Г.) = = СO2 + 4H2 |
Таким образом можно сделать следующие выводы:
1. Химическая реакция самопроизвольно протекает в направлении уменьшения значения DG.
2. Чем сильнее убывает величина DG,тем более вероятно проведение химической реакции в прямом направлении.
3. Если DG > 0, то химическая реакция не будет протекать в прямом направлении. Причём, если DG >> 0, то химический процесс можно осуществить в обратном направлении.
4. При DH < 0, DS > 0химическаяреакция возможна без ограничений; и, наоборот, при ΔH > 0, ΔS < 0химическая реакция, вообще, неосуществима.
 4. Термодинамические представления о равновесном состоянии.
4. Термодинамические представления о равновесном состоянии.
Константа химического равновесия Кр.зависит от природы реагентов и от температуры. Она связана с изменением стандартной энергии Гиббса химической реакции  уравнением:
уравнением:
 = - R T ln Kp (18)
= - R T ln Kp (18)
Если учесть, что  , то после некоторого преобразования получим:
, то после некоторого преобразования получим:
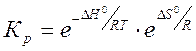 (19)
(19)
Из этого уравнения видно, что константа равновесия очень чувствительна к изменению температуры. Для эндотермических процессов повышение температуры отвечает увеличению константы равновесия, для экзотермических – её уменьшению.
От давления (если оно не очень велико) константа равновесия не зависит.
Зависимость константы равновесия от энтальпийного и энтропийного факторов свидетельствует о влиянии на неё природы реагентов.
- Понятие о скорости химической реакции.
- Зависимость скорости химичкой реакции от концентрации реагирующих веществ.
- Понятие об энергии активации.
- Зависимость скорости реакции от температуры.
- Катализ.
|
|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 955; Нарушение авторских прав?; Мы поможем в написании вашей работы!