
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение Нернста
|
|
|
|
Понятие о стандартном электродном потенциале.
Стандартный электродный потенциал металлического электрода – это потенциал этого электрода в растворе собственных ионов с их активностью, равной 1, измеренный по отношению к водородному электроду, потенциал которого равен нулю, в стандартных условиях. Например, Е0 Zn2+ /Zn = -0,76 B;
Е0 Cu2+ / Cu = 0,52 B.
Стандартные потенциалы металлических электродов в водных растворах приведены в таблице 1. Стандартные электродные потенциалы металлов указывают на меру окислительно-восстановительной способности металла и его ионов. Чем более отрицательное значение имеет потенциал металла, тем более сильной восстановительной способностью он обладает. И наоборот, чем более положителен потенциал металлического электрода, тем более сильной окислительной способностью обладает его ионы. Из таблицы 1 видно, что литий, имеющий наиболее отрицательный стандартный потенциал, относится к наиболее сильным восстановителям, а к наиболее сильным окислителям принадлежат ионы золота, платины, палладия, серебра и ртути. На основании величин стандартных электродных потенциалов металлов построен ряд напряжения металлов.
Электродный потенциал зависит от природы металла, температуры и концентрации ионов в растворе (уравнение Нернста):
ЕMn+ / M0 = E0Mn+ / M +  ln[Mn+(H2O)m],
ln[Mn+(H2O)m],
где Е0Mn+ / M0 - стандартный электродный потенциал металла, измеренный по отношению к водородному электроду (Е0 / 2 H + = 0 B), в стандартных условиях (1М раствор, 1 атм., 25оС), В;
/ 2 H + = 0 B), в стандартных условиях (1М раствор, 1 атм., 25оС), В;
R - газовая постоянная (8,314 Дж/мольК);
F – число Фарадея, 96500 Кл/моль экв;
n - зарядность металла;
T - температура;
Мn+(Н2О)m - концентрация ионов металла в растворе, моль/л.
Подставляя значения R, F, T = 298 К и множителя перехода от натуральных логарифмов (2,303) к десятичным, получаем удобную для применения формулу:
ЕMn+ / M0 = E0Mn+ / M0 + 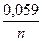 lg [Mn+(H2O)m].
lg [Mn+(H2O)m].
|
|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 511; Нарушение авторских прав?; Мы поможем в написании вашей работы!