
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общие свойства металлов
|
|
|
|
 Сочетание атомов одного и того же элемента есть простое вещество. В зависимости от типа химической связи между атомами простые вещества могут быть металлами и неметаллами. Для металлов характерна металлическая связь, для неметаллов–ковалентная. Примерно восемьдесят из более ста известных элементов представляют собой металлы. Металл можно определить как вещество, хорошо проводящее электричество и теплоту. Металл отличается характерным блеском, который так и называется – металлическим, из металлов можно выковывать листы (благодаря особому свойству - ковкости) и вытягивать проволоку (благодаря текучести).
Сочетание атомов одного и того же элемента есть простое вещество. В зависимости от типа химической связи между атомами простые вещества могут быть металлами и неметаллами. Для металлов характерна металлическая связь, для неметаллов–ковалентная. Примерно восемьдесят из более ста известных элементов представляют собой металлы. Металл можно определить как вещество, хорошо проводящее электричество и теплоту. Металл отличается характерным блеском, который так и называется – металлическим, из металлов можно выковывать листы (благодаря особому свойству - ковкости) и вытягивать проволоку (благодаря текучести).
Благодаря своим характерным свойствам металлыи их сплавы чрезвычайно ценны для человека. Современная цивилизация основана на применении железа и стали, причем ценные сорта стали изготовляют с включением в их состав наряду с железом таких металлов, как ванадийхром, марганец, кобальт, никель, молибден, вольфрам и др.
Свойства металлов, физические и химические, как и свойства других элементов и их соединений, определяются природой вещества, являются функцией строения атомов, а также зависят от прочности химических связей в кристалле. Особенностью структуры атомов металлов является малое количество электронов на внешнем слое (1 -2 электрона у s-, d-и f- элементов, 1- 4 электрона у р- элементов). В процессе кристаллизации атомы металлов легко сближаются и обобщают электроны. При этом направленного воздействия между атомами не наблюдается, и электроны внешних уровней могут свободно мигрировать от одного к другому, осуществляя "металлическую" связь. В электрическом поле движение этих электронов приобретает направленный характер, что обеспечивает электропроводность металла. Теплопроводность, пластичность металлов также объясняется спецификой металлической связи.
|
|
|
Химическая активность металлов определяется тем, что внешние электроны в атомах металлов, находясь на значительном расстоянии от
ядра, связаны с ним сравнительно слабо и могут быть легко отданы атомами с образованием положительных элементарных ионов:
 Me <=> Me+n
Me <=> Me+n + ne
+ ne
Поэтому, в химических превращениях свободные металлы всегда выступают в качестве восстановителей.
Количественно восстановительная способность металлов оценивается значениями ионизационного потенциала при взаимодействии металлов с элементарными окислителями (кислород, сера, галогены). Наиболее активными металлами являются s- металлы I-II групп и алюминий – р- металл III группы периодической системы Д.И. Менделеева, имеющие низкие значения ионизационных потенциалов.
В реакциях металлов со сложными окислителями химическая активность металлов характеризуется величиной стандартного электродного потенциала (Е°).
Сравнение восстановительной способности различных металлов можно провести, исходя из положения их в ряду напряжений, где металлы располагаются в порядке возрастания значений стандартных электродных потенциалов, т.е.порядке убывания их восстановительной функции.
Li,Cs,K,Ba,Ca,Na,Al,Mn,Zn,Cr,...Fe,Ni,Sn,Pb,H,Bi,Cu,Hg,Ag,Pt,Au
Чтобы рационально использовать ряд напряжений при написании уравнений окислительно-восстановительных реакций необходимо помнить следующее:
1) Чем левее в ряду напряжений находится металл, тем он химически активнее, обладает большой восстановительной способностью, легче окисляется и труднее восстанавливается из своих ионов.
2) Чем правее расположен металл, тем он химически менее активен, труднее окисляется и легче восстанавливается из его ионов.
3) Все металлы с отрицательной величиной потенциала, расположенные левее водорода, окисляются ионами гидроксония и выделяют водород из разбавленных растворов кислот, отрицательные ионы которых не проявляют окислительных свойств.
|
|
|
Однако, свинец в растворе H2SO4 (массовая доля кислоты ниже 80%) практически не окисляется, потому чтона его поверхности сразу же образуется защитный слой РbSO4, и реакция прекращается.
Напротив, металлы, расположенные правее водорода, не растворяются в разбавленных кислотах. Например, медь не окисляется в разбавленных НСl и H2SO4, а с концентрированными кислотами взаимодействует.
Пассивация имеет место и при взаимодействии металлов с разбавленными кислотами, нерастворимые продукты чаще всего образуются при взаимодействии металлов с НзРO4, Н2SОз, Н2СОз.
4) При взаимодействии металлов с растворами солей вытесняются, главным образом, малоактивные металлы, так как их ионы являются окислителями. Например, в реакции
Zn + CuCl2 = ZnCl2 + Си
 востановитель Zn - 2е
востановитель Zn - 2е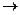 Zn+2 E0 Zn+2/Zn = -0.76В
Zn+2 E0 Zn+2/Zn = -0.76В
Е0ок > Е0восст.
 Окислитель Cu+2 + 2e
Окислитель Cu+2 + 2e 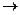 Сu Е0 Cu+2/Cu = 0.36В
Сu Е0 Cu+2/Cu = 0.36В
Исходя из того, что самопроизвольно окислительно-восстановительная реакция может проходить только в том случае, если электродный потенциал окислителя больше электродного потенциала восстановителя, можно сказать, что цинк способен восстановить ионы меди, а медь при тех же условиях не способна восстановить ионы Zn+2.
Наиболее активные металлы окисляются как в водной, так и вкислой среде, тогда как металлы, расположенные между цинком и водородом,
окисляются только в кислой среде, а образующие амфотерные пленки - и в щелочной среде.
Для реакции с водой активных металлов (щелочных и щелочноземельных) достаточно концентрации ионов водорода (Н+), образующихся при диссоциации воды, кроме того, их оксидные пленки, растворяясь в воде, не способны защитить металл от ее воздействия.
2Na + 2Н2O = 2NaOH + Н2.
Магний и цинк в виде пыли окисляются водой при 100°С. Менее активные металлы взаимодействуют с водой при высокой температуре.
2Fe + 3H2O = ЗН2 +Fe2O3
Смесь одного объема НNОз и трех объемов НС1 называют «царской водкой». Она растворяет платину, золото и другие неактивные металлы.

 Аu + НNОз + 4НС1 = H[АuСl4] + NO + 2Н2O 3Pt + 4HNO3 +18НС1 =3Н2[РtCl6] +4NO + 8Н2O. Некоторые металлы (W, Та, Nb) не растворяются в «царской водке», но их можно окислить в смеси НNОз и HF.
Аu + НNОз + 4НС1 = H[АuСl4] + NO + 2Н2O 3Pt + 4HNO3 +18НС1 =3Н2[РtCl6] +4NO + 8Н2O. Некоторые металлы (W, Та, Nb) не растворяются в «царской водке», но их можно окислить в смеси НNОз и HF.
|
|
|
W + 2HNO3 + 8НF = H2[WF8] + 2NO+ 4Н2O
Металлы, образующие амфотерные оксиды (цинк, олово, алюминий, свинец и др.), вступают в реакцию с растворами щелочей, в результате чего образуются соли и выделяется водород. Роль щелочи сводится к растворению образующейся на поверхности оксидной пленки с образованием комплексного соединения.
1)Аl2Оз+2NaOH+3H2O=2Na[Al(OH)4], далее А1, освобожденный от окисной пленки, взаимодействует с Н2O по реакции:
2)2А1 + 6Н2О = 2Аl(ОН)з + ЗН2
3)А1(ОН)з +NaOH =Na[Al(OH)4]
2А1 + 6Н2O +2NaOH = 2Na[Al(OH)4] +3H2
Если металл не окисляется ионами водорода кислоты, то он может взаимодействовать с кислотами, которые являются более сильными окислителями. К таким кислотам относятся серная (концентрированная), азотная (концентрированная и разбавленная), хлорноватистая и некоторые другие.
 В концентрированной серной кислоте окислителем является S042-благодаря наличию S+6. Стандартный электродный потенциал процессов восстановления иона S042- больше 0, поэтому концентрированная серная кислота способна окислять малоактивные металлы, например, медь и серебро:
В концентрированной серной кислоте окислителем является S042-благодаря наличию S+6. Стандартный электродный потенциал процессов восстановления иона S042- больше 0, поэтому концентрированная серная кислота способна окислять малоактивные металлы, например, медь и серебро:
 SO42-+4H++2е=SO2+2H2O E°=1.17 В
SO42-+4H++2е=SO2+2H2O E°=1.17 В

 SO42- +8H+ + 6e = S + 4H2O E° = 0.31 В
SO42- +8H+ + 6e = S + 4H2O E° = 0.31 В

 SO42-+10Н+ + 8e= H2S + 4H2O E° = 0.311 В
SO42-+10Н+ + 8e= H2S + 4H2O E° = 0.311 В
Как видно из приведенных схем, продукты восстановления серной кислоты могут быть различны в зависимости от условий (концентрации кислоты, температуры и активности металла).
Малоактивные металлы восстанавливают серную кислоту (H2S+6O4) до соединений серы (+4) S+4O2, Н2S+4Oз
Сu + H2SO4 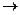 CuSO4 + SO2 + Н2O
CuSO4 + SO2 + Н2O
конц.
Активные металлы (Zn, Ca, Mg и др.) способствуют более глубокому восстановлению серной кислоты от (S+6) до серы (S°) и сероводорода H2S(S-2).
Mg + H2SO4 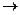 MgSO4 + S + H2O
MgSO4 + S + H2O
конц.
Mg+H2SO4 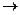 MgSO4+ Н2S + H2O
MgSO4+ Н2S + H2O
конц.
Азотная кислота обладает сильно выраженными окислительными свойствами благодаря наличию ионов NO3
Азот в составе NO3 может в зависимости от условий принимать от 1 до 8 электронов.

 NO3+2H++1e
NO3+2H++1e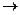 NO2+H2O Е°= 0.8В NOз+4H++Зe
NO2+H2O Е°= 0.8В NOз+4H++Зe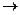 NO+2H2O Е°=0.96В 2NOз+12H++10e
NO+2H2O Е°=0.96В 2NOз+12H++10e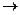 N2+6Н2O Е°=1.24В NОз +10H+ + 8e
N2+6Н2O Е°=1.24В NОз +10H+ + 8e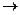 NH4+ + ЗН2O Е°=0.87В
NH4+ + ЗН2O Е°=0.87В

 Продукты восстановления азотной кислоты определяются ее концентрацией, температурой и активностью металла. Концентрированная азотная кислота восстанавливается при взаимодействии с малоактивными и активными металлами до соединений азота N+4 (NO2)
Продукты восстановления азотной кислоты определяются ее концентрацией, температурой и активностью металла. Концентрированная азотная кислота восстанавливается при взаимодействии с малоактивными и активными металлами до соединений азота N+4 (NO2)
|
|
|
Me(II)+HNO3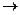 Ме(NОз)2 + NO2 + H2O
Ме(NОз)2 + NO2 + H2O
|
|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 453; Нарушение авторских прав?; Мы поможем в написании вашей работы!