
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение молекулярной массы полимеров, размера, свойств и формы макромолекул
|
|
|
|
Застудневание. Ранее указывалось, что при ограниченном набухании образуется студень, который представляет собой пространственную сетку из макромолекул полимера, заполненную молекулами растворителя. Однако может происходить и обратный процесс, когда раствор полимера переходит в состояние студня. Этот процесс называется застудневанием или желатинированием.
Сетчатые (пространственные) структуры формируются в студнях в результате возникновения водородных связей, электростатических взаимодействий или более прочных химических связей между различными участками макромолекул. Если связи в студне являются водородными или электростатическими, то прочность его мала, и он легко разрушается. Примером таких систем служат студни желатины и агар-агара.
Процесс застудневания протекает в течение определенного промежутка времени не только при комнатной температуре, но и при более низких температурах. Время, необходимое для формирования рыхлых сетчатых структур студней, называется периодом созревания.
На процесс застудневания существенно влияют размеры и разветвленность макромолекул полимеров. Особенно легко образуют студни ВМС, у которых длина макромолекул достигает нескольких тысяч ангстрем и в тысячи раз превышает их поперечные размеры.
Более концентрированные растворы ВМС при прочих равных условиях легче дают студни, чем разбавленные. Например, растворы желатины с ее массовой долей 2 % и более легко превращаются в студни при комнатной температуре. Растворы с меньшей массовой долей (0,5-1%) образуют неустойчивые студни, которые плохо сохраняют форму, а еще более разбавленные не желатинируются вовсе. Зависимость процесса образования студня от концентрации объясняется тем, что в более концентрированных растворах уменьшается расстояние между макромолекулами и поэтому увеличивается число их столкновений и облегчается образование структур за счет их сцепления активными центрами.
Повышение температуры способствует усилению поступательного и колебательного движения макромолекул и благоприятствует разрыву связей между ними, что затрудняет застудневание. При понижении температуры ускоряется агрегация макромолекул полимера, и процесс застудневания идет легче, вот почему растворы, не застудневающие при комнатной температуре, в случае ее понижения образуют твердые студни.
Электролиты по-разному влияют на скорость застудневания: одни - ускоряют, другие - замедляют, а некоторые - даже исключают возможность перехода ВМС в студень. На застудневание, главным образом, влияют анионы. Экспериментально установлено, что соли серной и уксусной кислот ускоряют процесс застудневания, хлориды и иодиды замедляют, а роданиды приостанавливают его.
Анионы располагаются в следующий ряд по мере уменьшения их действия на процесс застудневания:
SО42- > СНзСОO- > Сl- > Вr- > I- > СNS-.
Различия в указанных свойствах электролитов объясняются степенью их гидратации, которая уменьшается у анионов слева направо в данном ряду. Замедляющее действие анионов на процесс застудневания наблюдается, начиная с хлорид-иона.
Застудневание лучше всего протекает при рН раствора, соответствующем ИЭТ белка.
Студни являются гомогенными системами, которые обладают упругими свойствами, нетекучи и способны сохранять форму.
Упругость студней определяется прочностью и гибкостью макромолекулярной сетки, а также свойствами ориентированных слоев молекул растворителя. Особенно характерно это для полярных макромолекул в водной среде. Гидратные оболочки, окружающие полярные группы, создают упругую водную сетку. Таким образом, жидкость, заполняющую сетку студня, можно условно разделить на две части; «свободную» и «связанную», входящую в состав сольватных оболочек.
Связанная вода обладает особыми свойствами: большей плотностью, пониженной температурой замерзания (до -15 °С), потерей растворяющей способности и т.д. Связанная вода студней играет большую роль в нашей жизни, поскольку присутствие ее в почве, растениях, во всех живых организмах обеспечивает морозоустойчивость, поддерживает «водные запасы», определяет морфологические структуры клеток и тканей.
При старении студни теряют гомогенность. Это явление называют синерезисом. Он сопровождается уплотнением пространственной структурной сетки и уменьшением объема студня за счет выделения жидкой фазы. Примеры синерезиса - отделение сыворотки при свертывании крови, при скисании молока и др. Студни не способны восстанавливать свою структуру.
Из-за наличия пространственной сетки в студнях отсутствует перемешивание. Поэтому в них реагирующие вещества соприкасаются в результате медленной диффузии, и химические реакции имеют свои особенности, в частности специфически протекают реакции осаждения. Например, если в студень желатины заранее ввести некоторое количество дихромата калия, а затем добавить более концентрированный раствор нитрата серебра, то возникает окрашенный осадок дихромата серебра:
К2Сr2О7 + 2 AgNO3 = Ag2Сr2О7↓+ 2KNO3
При стоянии в результате диффузии нитрата серебра осадок распространяется вглубь студня, но не сплошной массой: возникают периодические зоны осадка, отделенные друг от друга совершенно прозрачными промежутками. Эти реакции получили название периодических. Их впервые наблюдал немецкий химик Р. Лизенганг (1886).
Периодическими реакциями объясняют сложное распределение окраски многих минералов, генерацию нервных импульсов, мышечные сокращения, сложное строение камней, образующихся в почках, печени и желчном пузыре.
Коацервация. При нарушении устойчивости раствора белка или полисахарида возможно образование коацервата - новой жидкой фазы, обогащенной биополимером. Коацерват может выделяться в виде капель или образовывать сплошной слой, что приводит к расслаиванию системы на две фазы. Одна из фаз представляет собой раствор ВМС в растворителе, а другая - раствор растворителя в ВМС.
Коацервацию можно вызвать изменением температуры, рН среды или введением низкомолекулярных веществ.
Наиболее изучена коацервация белков и полисахаридов в водных растворах. Л.И. Опарин считал, что коацерваты сыграли большую роль в процессах происхождения жизни на Земле.
Вискозиметрия - это гидродинамический метод, основанный на измерении вязкости жидкостей и растворов. Метод позволяет определить относительную молекулярную массу растворенного полимера, а также получить данные о размерах и форме его молекул. Вязкость можно определять различными способами, например методом истечения жидкости через капилляр, методом падающего шарика и др.
Определение вязкости методом истечения жидкости основано на измерении времени истечения одинаковых объемов раствора и растворителя через один и тот же капилляр и при одной и той же температуре, что позволяет рассчитать относительную вязкость.
Согласно закону Пуазейля объем жидкости V, перетекающей через капиллярную трубку, прямо пропорционален времени перетекания t, давлению столба жидкости р, четвертой степени радиуса капилляра г и обратно пропорционален длине капилляра l и вязкости ή:

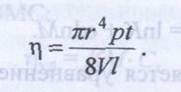
| также объем вытекающей жидкости V постоянны. Следовательно, их можно заменить константой k |
 Для измерения вязкости данным методом чаще используют капиллярные вискозиметры, представляющие собой видоизмененные варианты вискозиметра Оствальда. Для данного вискозиметра длина капилляра l и ее радиус г, а Тогда уравнение принимает вид
Для измерения вязкости данным методом чаще используют капиллярные вискозиметры, представляющие собой видоизмененные варианты вискозиметра Оствальда. Для данного вискозиметра длина капилляра l и ее радиус г, а Тогда уравнение принимает вид 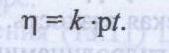
Согласно данному уравнению при постоянном давлении столба жидкости вязкость пропорциональна времени истечения.
В таком случае относительная вязкость выражается следующим уравнением:
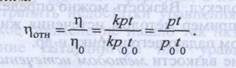
Если жидкости вытекают под влиянием собственной тяжести при равных высотах столба жидкости, то отношение давлений можно заменить отношением плотностей.
Поскольку при измерении вязкости разбавленных растворов ВМС плотности растворителя и раствора считают равными друг другу, то относительную вязкость рассчитывают по формуле

где t - время истечения разбавленного раствора ВМС; t0 - время истечения чистого растворителя.
Измерив время истечения растворителя и растворов с различными концентрациями полимера и рассчитав последовательно относительную, удельную и приведенную вязкости для этих растворов, строят график зависимости приведенной вязкости ήуд/С от концентрации С. Прямую экстраполируют на ось ординат и находят значение [ή]. Затем по уравнению рассчитывают относительную молекулярную массу полимера.
Применение вискозиметрии для медико-биологических исследований Величина характеристической вязкости позволяет определить как относительную молекулярную массу полимера, так и размеры и форму ее макромолекул. Например, если растворы белков характеризуются величинами [ή], лежащими между 3,0 и 4,0 см3/г, то столь малое значение данных величин указывает на глобулярную, весьма компактную структуру этих белков, форма которых незначительно отличается от сферы. Большие значения [ή] указывают либо на высокую степень асимметричности белков, либо на большой объем, занимаемый данными белками в растворе.
Зависимость приведенной вязкости растворов биополимеров от их концентрации для макромолекул с разными значениями относительной молекулярной массы графически выражается прямыми с разным наклоном, который тем меньше, чем меньше масса макромолекулы (рис.10).


|
Угол наклона прямых в этих же координатах зависит и от формы макромолекул. При одинаковых М для молекул со сферической симметрией прямая более пологая, чем для стержней.
При вискозиметрическом определении относительных молекулярных масс биополимеров используются разнообразные

|
эмпирические формулы, связывающие [ή] с М. Например, для белков, подвергнутых денатурации в 6 М растворе хлорида гуанидиния (вещество, которое разрывает все водородные связи так, что белок превращается в статистический клубок, если отсутствуют дисульфидные связи внутри одной ППЦ) известно следующее соотношение: 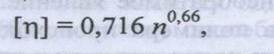
где п – число аминокислотных остатков в белке
Зная среднюю молекулярную массу на один остаток, равную 115, и число аминокислотных остатков в белке, можно рассчитать его относительную молекулярную массу.
Для двухцепочечных линейных молекул ДНК было найдено, что соотношение между [ή] и М можно записать таким образом:
0,665 lgM= 2,863 + lg ([ή]+ 5)
Это истинно эмпирическое уравнение можно использовать для вычисления М при условии, что образец ДНК гомогенен по молекулярной массе. Данное ограничение следует иметь в виду вследствие большой чувствительности ДНК к деградации в процессе выделения и очистки.
|
|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 2553; Нарушение авторских прав?; Мы поможем в написании вашей работы!