
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лиофильные дисперсные системы
|
|
|
|
ЛИОФИЛЬНЫЕ ДИСПЕРСНЫЕ СИСТЕМЫ
Лекция 5
Связь уравнения Ленгмюра с уравнением изотермы Шишковского.
 6.4.1.
6.4.1.
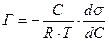 6.4.2.
6.4.2.
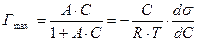 6.4.3.
6.4.3.
 6.4.4.
6.4.4.
 6.4.5.
6.4.5.
Пусть  6.4.6.,
6.4.6.,
тогда
 6.4.7.
6.4.7.
Проинтегрируем уравнение 6.4.7.
 6.4.8.
6.4.8.

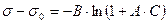
 6.4.9.
6.4.9.
В этом уравнении константа 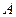 следует из правила Дюкло-Траубе.
следует из правила Дюкло-Траубе.
Лиофилъные коллоидные системы характеризуются равновесным распределением частиц дисперсной фазы по размерам, которое не зависит от пути получения такой системы — диспергированием макрофазы или конденсацией молекул при увеличении концентрации вещества дисперсной фазы. Образование лиофильных коллоидных систем особенно характерно для ПАВ, обладающих ионогенной или большой по размеру неионной полярной группой и длинной углеводородной цепью. Способность подобных ПАВ к мицеллообразованию — самопроизвольному возникновению равновесной коллоидно-дисперсной системы с частицами различной формы и размеров — лежит в основе их широкого применения в различных областях. Ряд особенностей поведения и строения систем вблизи критической температуры абсолютного смешения фаз, а также некоторых полимерных систем, позволяют говорить, что они имеют общие черты с лиофильными коллоидными системами.
Образование частиц дисперсной фазы приводит к увеличению свободной энергии системы за счет возрастания свободной поверхности энергии Δ = σΔS при увеличении площади межфазной поверхности S. Вместе с тем, образование частиц дисперсной фазы, включающихся в самостоятельное броуновское движение, вызывает рост энтропии системы уменьшение свободной энергии Δ системы на величину ТΔ, что может существенно изменять соотношение между энергиями макрофаз и дисперсной системы.
Если уменьшение свободной энергии системы из-за прироста энтропии компенсирует ее увеличение, связанное с развитием новой поверхности, так что в минимуме кривой Δ (lg d)изменение свободной энергии оказывается отрицательным Δ min < 0, то образование коллоидной системы оказывается термодинамически выгодным процессом и может происходить самопроизвольно. При постоянном составе фаз условие термодинамической выгодности образования дисперсной системы из макрофазы имеет вид:
4π r 2σ < βk T.
По Ребиндеру и Щукину, это условие имеет простой физический смысл: если межфазное натяжение мало, то возможно самопроизвольное отщепление частиц коллоидных размеров от макрофазы, поскольку работа, затрачиваемая на образование новой поверхности, компенсируется выигрышем энергии в результате прироста энтропии из-за участия образующихся частиц в тепловом движении. В соответствии с уравнением
такой процесс самопроизвольного диспергирования макрофазы оказывается выгодным, если поверхностное натяжение не превышает критического значения σс:
где β' = β/α. При возникновении лиофильных коллоидных систем с достаточно малой концентрацией частиц дисперсной фазы, когда число частиц много меньше числа молекул дисперсионной среды, β ≈ 15 − 30. Таким образом, величина σс зависит от размера и концентрации образующихся частиц дисперсной фазы и для частиц радиусом ~ 10−8 м составляет при комнатной температуре десятые или сотые доли мДж/м2. Поскольку критериальное значение σс зависит от размера частиц d, образование дисперсной системы с более крупными частицами возможно только при более низких значениях σ.
Если дисперсия самопроизвольно возникает из макрофазы при σ < σс (и не обнаруживает при этом тенденции к дальнейшему дроблению частиц до отдельных молекул), то она является термодинамически устойчивой. Ребиндер предложил называть подобные дисперсии лиофильными коллоидными системами. Для лиофильных коллоидных систем характерно равновесное распределение частиц по размерам, которое не зависит от пути их возникновения — при диспергировании макроскопической фазы или в результате агрегирования молекул при концентрировании системы.
Образование равновесной коллоидно-дисперсной системы возможно при условии, что значение dт лежит в той области дисперсности, где размер частиц заметно превышает молекулярные размеры b, т. е. dт» b, например, в области dт ≥ (5 - 10) b. Тогда условие самопроизвольного образования лиофильной коллоидной системы из макрофазы и, соответственно, ее термодинамической равновесности относительно этой макрофазы можно записать в виде критерия, сформулированного Ребиндером и Щукиным:
Этот критерий эквивалентен условию самопроизвольного диспергирования макрофазы (). Таким образом, при достаточно низких, но конечных положительных значениях σ, когда σ ≤ σс, т. е. при KS ≈ 5 − 10, могут самопроизвольно путем диспергирования макрофазы возникать термодинамически равновесные лиофильные дисперсные системы с заметной концентрацией частиц дисперсной фазы, существенно превосходящих молекулярные размеры.
Важнейшим представителем лиофильных дисперсных систем являются мицеллярные дисперсии некоторых ПАВ, в которых наряду с отдельными молекулами присутствуют коллоидные частицы (мицеллы) — ассоциаты молекул ПАВ с достаточно большим числом агрегации (числом молекул в мицелле) т = 20 ÷ 100 и более. При образовании таких мицелл в полярном растворителе (воде) углеводородные цепи молекул ПАВ объединяются в углеводородное ядро, а гидратированные полярные группы, обращенные в сторону водной фазы, образуют гидрофильную оболочку. Благодаря гидрофильности наружной оболочки, экранирующей углеводородное ядро от контакта с водой, поверхностное натяжение на границе мицелла — среда оказывается сниженным до значений σ < σс, что и обусловливает термодинамическую устойчивость мицеллярных систем относительно макрофазы ПАВ.
Термодинамически устойчивые дисперсии мицелл могут в определенных условиях самопроизвольно возникать при контакте кристаллической или жидкой макрофазы ПАВ с дисперсионной средой. И хотя состояние вещества в мицелле не полностью эквивалентно макрофазе, достаточно высокое число агрегации молекул в мицеллах позволяет рассматривать их как частицы иной, по сравнению с молекулярным раствором, фазы. Мицеллярные дисперсии ПАВ обнаруживают свойства, присущие коллоидно-дисперсным системам, прежде всего светорассеяние.
Способностью к мицеллообразованию обладают не все ПАВ, а только те, которые имеют оптимальное соотношение между гидрофобной (углеводородный радикал) и гидрофильной (полярная группа) частями, что определяется гидрофильно-липофильным балансом (ГЛБ). К мицеллообразующим ПАВ (четвертая группа ПАВ по классификации П.А. Ребиндера) относятся натриевые и аммониевые соли жирных кислот с длиной цепи С12−20, алкилсульфаты, ал-килбензолсульфонаты и другие синтетические ионогенные и неио-ногенные ПАВ. Истинная растворимость, т. е. равновесная концентрация вещества, находящегося в водном растворе в молекулярной (или ионной) форме, для таких ПАВ невелика и составляет для ионо-генных ПАВ сотые или тысячные доли кмоль/м3, а для неионогенных — может быть еще на один-два порядка ниже.
В склонности ПАВ образовывать мицеллярные системы весьма существенную роль играет способность полярных групп к экранированию углеводородного ядра от контакта с водой. Эта способность определяется не только собственными размерами полярных групп, но и их природой (ионогенная, неионогенная) и характером взаимодействия с растворителем, в частности гидратируемостью. С уменьшением числа агрегации т уменьшаются и размеры мицелл, а соответственно уменьшается отношение числа молекул в мицелле (и, соответственно, числа полярных групп) к ее поверхности; вследствие этого степень экранирования углеводородного ядра полярными группами должна падать. В результате этого уменьшение размера мицелл вызывает резкое увеличение эффективного значения σ с уменьшением их радиуса r. Поэтому термодинамически выгодно существование мицелл сферической формы с некоторым оптимальным числом агрегации молекул, обычно таким, которое отвечает частицам коллоидных размеров с радиусом r, близким к длине углеводородной цепи l м. Например, диаметр устойчивых мицелл олеата натрия составляет ~ 5 нм, что отвечает числу агрегации молекул т порядка нескольких десятков.
Образование мицелл со значительно большими числами агрегации т (т. е. при r > l м) с сохранением сферической формы термодинамически невыгодно, поскольку должно сопровождаться вхождением полярной группы в углеводородное ядро мицеллы. Вследствие этого число агрегации молекул в мицеллах растет не за счет увеличения размера сферических мицелл, а за счет изменения их формы — перехода к асимметричному строению.
Возникновение в дисперсионной среде коллоидных частиц (мицелл ПАВ) в результате самопроизвольного диспергирования макрофазы или путем самопроизвольного объединения (конденсации) отдельных молекул при увеличении содержания ПАВ в растворе соответствует качественному изменению системы — ее переходу из макрогетерогенного или гомогенного состояния в микрогетерогенную коллоидную дисперсию. Это качественное изменение сопровождается резким экспериментально фиксируемым изменением физико-химических свойств системы, которое в большинстве случаев выражается в появлении характерных изломов на кривых зависимости физико-химических параметров от концентрации ПАВ.
С увеличением содержания ПАВ в растворе выше некоторой критической концентрации ск наблюдается заметный рост светорассеяния, указывающий на возникновение новой коллоидно-дисперсной фазы; изотермы поверхностного натяжения вместо обычного плавного хода, описываемого уравнением Шишковского, обнаруживают излом при с = ск, а при дальнейшем росте концентрации значения σ остаются практически неизменными. Аналогично при с = ск излом появляется и на кривых концентрационной зависимости удельной и эквивалентной (Λ) электрической проводимости растворов ионогенных ПАВ и т. д. Концентрацию ск, выше которой начинается мицеллообразование, называют критической концентрацией мицеллообразования (ККМ). Резкое изменение свойств системы ПАВ — вода вблизи ККМ позволяет по точкам излома концентрационных зависимостей многих физико-химических величин с большой точностью определять значения ККМ.
Аналогично тому как в водных растворах ПАВ возникают мицеллы с ориентацией полярных групп в сторону водной фазы, в растворах ПАВ в углеводородах могут образовываться мицеллы с противоположной ориентацией молекул. При формировании таких обратных мицелл полярные группы объединяются в гидрофильное (олеофобное) ядро, а углеводородные радикалы, обращенные в сторону родственной им неполярной среды, образуют олеофильную оболочку, экранирующую внутреннюю гидрофильную часть мицеллы от контакта с углеводородной средой.
ПАВ, образующие мицеллы в неполярных растворителях, как правило, нерастворимы в воде; баланс гидрофильных и олеофильных свойств их молекул резко сдвинут в сторону олеофильности. Число агрегации m молекул в обратных мицеллах значительно ниже, чем в прямых мицеллах. Это в значительной степени определяется структурой молекул: в данном случае ядро мицелл состоит из небольших по сравнению с углеводородными радикалами полярных групп. Поэтому необходимая для обеспечения термодинамической устойчивости мицелл степень экранировки ядра достигается при меньших степенях ассоциации, т. е. меньшем числе олеофильных групп на поверхности мицеллы.
При мицеллообразовании в неводных средах существенна роль полярности (неполярности) растворителя, определяющая интенсивность взаимодействия его молекул с полярной и неполярной частями молекул ПАВ. Для мицеллообразования необходимо, чтобы среда являлась «хорошим растворителем» для углеводородных радикалов. В средах, одинаково родственных обеим частям дифильных молекул ПАВ, мицеллообразование не происходит, и ПАВ обнаруживают в таких средах только истинную растворимость. Примером таких сред могут служить низшие спирты, которые являются хорошими растворителями и для полярной, и для неполярной частей молекул ПАВ.
В отличие от водной среды мицеллообразование в неполярных средах имеет не энтропийную, а «силовую» природу, заключающуюся в выгодности замены связи полярная группа – углеводород (при молекулярном растворении) на связь между полярными группами при их объединении в ядро мицеллы. Энергетический выигрыш системы при объединении полярных групп настолько существенен, что и при самых малых концентрациях истинных растворов ПАВ может находиться не в виде отдельных молекул, а в виде небольших предмицеллярных ассоциатов.
Введение в систему третьего компонента может в зависимости от его природы либо затруднять мицеллообразование, либо (что наблюдается чаще) способствовать этому процессу. Подавление ассоциации молекул ПАВ в мицеллы происходит при введении в водный раствор ПАВ значительных количеств полярных органических веществ, например низших спиртов. Такие вещества увеличивают молекулярную растворимость ПАВ и вследствие этого затрудняют мицеллообразование. Введение этих же веществ, но в малых количествах, и особенно добавление неполярных углеводородов, приводит к некоторому понижению ККМ, т. е. облегчает мицеллообразование. При этом существенно изменяется строение мицелл: введенный в качестве добавки третий компонент входит в состав мицеллы. В результате практически нерастворимые в чистой воде углеводороды растворяются в мицеллярных дисперсиях ПАВ. Это явление — включение в состав мицелл третьего компонента, нерастворимого или слаборастворимого в дисперсионной среде, называют солюбилизацией. Различают прямую солюбилизацию (в водных дисперсиях ПАВ) и обратную (в углеводородных системах).
В некоторых случаях солюбилизация сопровождается значительным увеличением скорости химического взаимодействия, что лежит в основе нового направления химической кинетики - мицеллярного катализа.
Способностью к агрегированию в растворах и образованию термодинамически равновесных лиофильных коллоидных систем обладают не только асимметричные по строению молекулы низкомолекулярных ПАВ, но и высокомолекулярные соединения (ВМС), особенно те, в молекулах которых имеются резко различающиеся по полярности участки. Свойства возникающих при этом систем близки к свойствам мицеллярных систем, образованных низкомолекулярными ПАВ, несмотря на то, что отдельные частицы могут здесь формироваться при агрегировании всего нескольких крупных молекул. Во многих случаях, например в растворах глобулярных белков, и одиночные макромолекулы ведут себя как частицы, близкие по свойствам мицеллам ПАВ.
Как известно, ВМС способны к образованию термодинамически равновесных молекулярных растворов с особыми термодинамическими свойствами, обусловленными гибкостью цепей макромолекул, обладающих большим числом конформаций. Вместе с тем исследования последних лет показали, что для этих систем характерно развитие процессов ассоциации макромолекул в растворах. В зависимости от характера взаимодействия макромолекул друг с другом и с молекулами растворителя и от концентрации раствора макромолекулы могут существовать либо в виде гибких цепей (статистических клубков), либо как плотные глобулы свернутых цепей, либо в виде ассоциатов. При развитой мозаичности (различии полярности участков цепей макромолекул) макромолекулы могут обладать значительной поверхностной активностью. Для подобных веществ характерна также резко выраженная склонность к агрегированию молекул и их глобулизации наряду со способностью к солюбилизации нерастворимых в данной среде веществ.
Значительной способностью к солюбилизации углеводородов обладают молекулы некоторых белков и ферментов, причем солюбилизи-рованные молекулы способны встраиваться в определенные участки этих макромолекул.
Большое значение исследований агрегирования макромолекул и их ассоциации с другими молекулами, так же как и процессов солюбилизации, определяется тем, что все эти явления лежат в основе многих процессов, происходящих в живых организмах (образование мембран и клеточных структур, обменные процессы, ферментативный катализ и т. д.).
Образование лиофильных коллоидных и близких к ним систем может происходить и при расслоении растворов высокомолекулярных веществ, а также смесей полимеров в твердом состоянии. Характерным явлением при расслоении растворов является образование так называемых коацерватов - своеобразных зародышей новой фазы, содержащих более высокую концентрацию высокомолекулярного вещества по сравнению с окружающей средой. В настоящее время предполагается, что явление коацервации послужило второй (после образования адсорбционных слоев) стадией упорядочивания (структурирования) органического вещества на пути возникновения жизни на Земле.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 1610; Нарушение авторских прав?; Мы поможем в написании вашей работы!