
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основания
|
|
|
|
Кислоты
Кислотами в принципе являются большинство органических соединений, т.к. они содержат Н-атомы.
Атом, с которым связан Н, – центр кислотности. Это могут быть атомы
C, O, N, S. Соответственно – CH-, OH-, NH- и SH-кислоты.
Центрами основности являются атомы, имеющие неподеленную пару электронов (n-электроны): N, O, S.
Соответственно различаются аммониевые, оксониевые и тиониевые основания (n-основания). Это могут быть нейтральные молекулы или анионы.
Существуют также π-основания – соединения с кратными связями или сопряженной системой π-связей. Они присоединяют протон, образуя сопряженные кислоты – π-комплексы.
Количественная оценка кислотности
Сила кислоты – это степень сдвига вправо следующего равновесия:
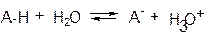
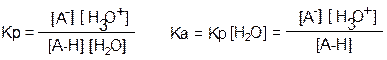
Ка – константа кислотности Ка ↑ - сила кислоты ↑
рКа = -lgKa – показатель кислотности; р Ка ↑ - сила кислоты ↓
Количественная оценка основности
Сила основания – это степень сдвига вправо следующего равновесия:
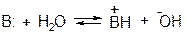

рКвн+ - мера силы основания В: рКвн+ ↑ - сила основания В ↑
Качественная оценка кислотности и основности
Кислоты
(!) Сила кислоты определяется устойчивостью сопряженного основания (аниона). Чем стабильнее анион, тем сильнее кислота.
Устойчивость аниона, в свою очередь, зависит от следующих факторов:
- ЭО и поляризуемость атома в центре кислотности;
- степень делокализации (-)-заряда в анионе;
- способность аниона к сольватации.


Природа атома в центре кислотности
Ряд увеличения кислотности:
CH < NH < OH < SH
C, N, O – по возрастанию ЭО;
S-Н – высокая поляризуемость связи (из-за большого радиуса S) и её пониженная прочность; большая делокализация заряда в анионе.
SH-кислоты – самые сильные, только они способны образовывать устойчивые соли с металлами. Они образуют очень прочные комплексы с тяжелыми металлами и применяются для их детоксикации и выведения из организма.
Сопряжение
Делокализация заряда по сопряженной системе увеличивает стабильность аниона и соответственно увеличивает кислотность.
(Объяснить на примере "этанол – фенол – уксусная кислота")
Влияние заместителей
Электроакцепторы усиливают кислотность;
электронодоноры её уменьшают

Эффект сольватации
Сольватация образующего аниона способствует его устойчивости и увеличивает кислотность.
(!) Чем меньше размер иона и чем больше в нем локализован заряд, тем легче он
сольватируется.

Основания
Наиболее сильные основания – анионы: НО-, RO-, NH2-, HS-.
В реакциях с кислотами нейтральные молекулы образуют ониевые соли:

Выделяются три типа органических оснований:
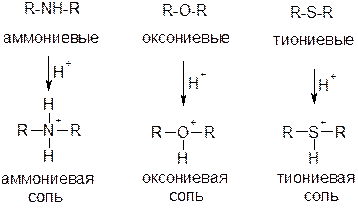
Сила основания определяется стабильностью образующегося катиона, а также доступностью неподеленной пары электронов для присоединения протона.
На силу основания влияют те же факторы, что и на силу кислоты, но направление их действия противоположно.
Ряд уменьшения основности:
R-NH-R > R-O-R > R-S-R > π-основания
- основность оксониевых оснований уменьшается за счет большей ЭО кислорода;
- тиониевые основания более слабые, чем оксониевые потому, что больший
радиус серы увеличивает длину связи S-H в катионе, делает её менее прочной
и тем самым снижает устойчивость катиона.
Амины – наиболее сильные основания. Они образуют с кислотами устойчивые соли растворимые в воде. Это свойство аминов широко применяется для их выделения и очистки, а также для получения растворимых лекарственных форм.
На силу оснований большое влияние оказывают заместители у центра основности:
а) электроноакцепторы
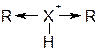
Электроноакцепторы увеличивают (+)-заряд на катионе, уменьшают его устойчивость и, следовательно, уменьшают основность.
б) электронодоноры

Электронодоноры уменьшают (+)-заряд на катионе, увеличивают его устойчивость и, следовательно, увеличивают основность.
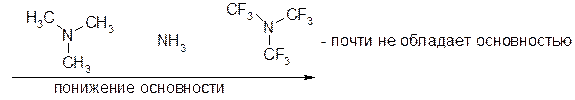
Включение неподеленной электронной пары в сопряженную систему понижает её доступность для присоединения протона и снижает основность:

Амиды: основность по сравнению с аминами резко снижена, в водных растворах не протонируются (основность ниже, чем у воды):

Теория кислот и оснований Льюиса
Кислота – акцептор электронов;
Основание – донор электронов
При взаимодействии кислот и оснований образуются донорно-акцепторные комплексы:

ИЗМЕНЕНИЕ КИСЛОТНОСТИ И ОСНОВНОСТИ
ПРИ ДЕЙСТВИИ РАЗЛИЧНЫХ ФАКТОРОВ
| Воздействующие факторы | Кислотность | Основность | |
| Электроотрицательность центрального атома | ↑ | ↑ | ↓ |
| ↓ | ↓ | ↑ | |
| Сопряжение центрального атома | ↑ | ↓ | |
| Заместители - электроноакцепторы | ↑ | ↓ | |
| Заместители - электронодоноры | ↓ | ↑ | |
| Сольватация образующегося аниона | ↑ |
ЛИТЕРАТУРА:
Основная
1. Белобородов В.Л., Зурабян С.Э., Лузин А.П., Тюкавкина Н.А. – Органическая химия (основной курс) – Дрофа, М., 2003 г., с. 138 – 157.
Дополнительная
1.Н.А.Тюкавкина, Ю.И.Бауков – Биоорганическая химия – ДРОФА, М.,
2007 г., с.100-111.
11.08.09
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 411; Нарушение авторских прав?; Мы поможем в написании вашей работы!