
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 27. Газовые растворы
|
|
|
|
27.1. Растворы газов в жидкостях. Закон Генри и Генри – Дальтона.
27.2. Растворы газов в металлах и сплавах. Закон Сивертса.
27.1. Растворы газов в жидкостях. Закон Генри и Генри – Дальтона.
Растворимость газов. Растворимость газов в жидкостях зависит от их природы, природы растворителя, температуры и давления. Как правило, растворимость газов больше, если растворение сопровождается химическим взаимодействием его с растворителем и меньше, если при этом химического взаимодействия не происходит. Аммиак реагирует с водой с образованием гидроокиси аммония и в одном объеме воды его растворяется 748,8 объема, в то же время инертного газа гелия может раствориться всего лишь 0,0139 объема.
Зависимость растворимости газов от природы растворителя можно показать на следующих примерах. При одинаковых условиях в 100 г воды растворяется 87,5 г аммиака, а в 100 г этилового спирта – только 25 г. Растворимость газов в значительной мере зависит от температуры. При повышении температуры растворимость их уменьшается, а при понижении увеличивается. Так, при О0С в 100 мл воды растворяется 171 см3 углекислого газа, а при 200С – только 87,8 см3.
Растворимость газа зависит тоже от давления.
Давление мало сказывается на растворимости твердых тел и жидкостей, но существенно влияет на растворимость газов.
Если при испарении жидкости в пар переходят молекулы, обладающие повышенной (по сравнению со средней) кинетической энергией, то, очевидно, из газа в жидкий раствор должны переходить молекулы, обладающие пониженной кинетической энергией. Их доля тем меньше, чем выше температура, - поэтому растворимость газов уменьшается с температурой. При заданной температуре количество таких молекул пропорционально давлению газа. Следовательно, количество растворенного в жидкости газа должно быть пропорционально его давлению, что выражается законом Генри: при данной температуре концентрация растворенного газа пропорционально его парциальному давлению
Сi = КiРi, (5.11)
где С i – концентрация газа в растворе; Рi – его парциальное давление; Кi – константа Генри, которая зависит от природы газа и растворителя, а ее численное значение определяется выбором единиц давления и концентрации.
В то же время при данной температуре доля молекул, обладающих определенной кинетической энергией, не зависит от давления (пока газ можно считать идеальным), поэтому объем газа, растворяющегося в определенном объеме растворителя, не зависит от давления. (Например, в 100 г воды при 20оС и давлении 760 мм рт. ст. растворяется 0,169 г углекислого газа. При увеличении давления вдвое масса растворяющегося газа тоже удваивается и становится равной 0,338 г. При увеличении давления вдвое плотность газа тоже увеличивается вдвое, так как 0,338 г этого газа при увеличении давления вдвое занимают тот же объем, что и 0,169 г его при 760 мм рт.ст. Следовательно, объем газа, растворяющегося в данном объеме жидкости, не зависит от давления).
Это обстоятельство прямо следует из закона Генри. Действительно, пусть в 1 л растворителя при температуре Т и давлении Р растворяется п моль газа. Объем растворившегося газа Vг равен
Vг = 
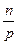 RT (5.12)
RT (5.12)
Из закона Генри следует, что Ср-р/Р = К, но Ср-р = п / РVр-ль , откуда
п / РVр-ль = К и п / Р = КV р-ль.
При постоянной температуре Vр-ль = const, а значит, n/P = const и Vг = const ּ RT не зависит от давления. Поэтому растворимость газов в жидкостях характеризуют отношением объема газа к объему растворителя – обычно числом миллилитров газа, растворяющегося в 1 л растворителя.
Из закона Генри вытекает следствие: так как давление газа Р пропорционально его концентрации сг в газовой фазе, то
сг = К сж (5.13)
откуда
К= 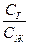 , (5.13а)
, (5.13а)
где сг – концентрация газа в газовой фазе; сж – концентрация газа в жидкости, т.е. отношение концентрации данного газа над раствором к концентрации того же газа в жидкости, есть величина постоянная.
Как уже указывалось выше, константа Генри (К) зависит от температуры, природы компонентов раствора и способа выражения его состава.
После замены молярной концентрации (С) мольной долей (χ)растворённого вещества получим
χi = Ki Pi (5.14)
При этом К/ i отличается от Кi.
Газы подчиняются закону Генри при не очень высоких давлениях и притом лишь в случае, когда они не вступают в химическое взаимодействие с растворителем. При высоких давлениях, когда поведение всех газов заметно отличается от идеального, отклонения от закона Генри наблюдаются и в случае газов, химически не взаимодействующих с растворителем.
На практике обычно приходится работать не с чистыми газами, а с их смесями. Так как при низких давлениях и высоких температурах газовые смеси подчиняются закону Дальтона, действие закона Генри распространяют и на смеси газов:
при постоянной температуре растворимость каждого компонента идеальной газовой смеси в жидкости прямо пропорциональна его парциальному давлению в смеси газов над раствором.
Опыт показывает, что растворимость газов в жидкостях зависит не только от температуры и давления, но и от примесей, содержащихся в жидкости. Так, присутствие электролитов в воде сильно (до десятка раз) снижает растворимость газов в ней. Этим широко пользуются в лабораторной практике при приготовлении запорных жидкостей для газометров и аспираторов.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1549; Нарушение авторских прав?; Мы поможем в написании вашей работы!