
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Случай 3: Титрование слабого основания сильной кислотой
|
|
|
|
Исходный раствор имеет рН > 7. При добавлении к нему титранта сильной кислоты – образуется соль, содержащая катион слабого основания. Например, если к NH3 добавлять HCl:
NH3 • H2O + HCl  NH4Cl + H2O
NH4Cl + H2O
После начала титрования в р-ре присутствует основание и его соль, т.е. р-р представляет собой буферную систему. В ТЭ – только соль, которая гидролизуется и определяет рН р-ра. После ТЭ – в растворе избыток кислоты, которая подавляет гидролиз соли.
Рассчитаем рН:
1) рН исходного р-ра рН = 14 – 0,5 (рКв +рСв),
где Кв- const диссоциации основания
Св – его концентрация.
2) рН до ТЭ
pH = 14 – pKb + lg (Cb/Ca)
Cb и Ca – концентрация слабого основания и образовавшейся соли соответственно.
Сb = nb/V, Сa=na/V
где nb и na – количество эквивалентов слабого основания и образовавшейся соли в растворе, V – объём раствора, равный V=V(X) + V(T)
тогда
nb = C′(X)V(X) - C′(T)V(T), na = C′(T)V(T)
[C′(X)V(X) - C′(T)V(T)]
 Cb=
Cb=
[V(X) + V(T)]
C′(T)V(T)
 Ca=
Ca=
[V(X) + V(T)]
подставляем Cb и Ca
[C′(X)V(X) - C′(T)V(T)]
 pH = 14 - pKb + lg (7)
pH = 14 - pKb + lg (7)
C′(T)V(T)
3) рН в ТЭ
pH = 7 – 0,5(pKB + lgCa)
Ca – концентрация образовавшейся соли
C′(X)V(X)
 Ca=
Ca=
[V(X) + V(T)]
рН = 7 – 0,5(рКв + lg  ) (8)
) (8)
4) рН после ТЭ
рН=-lg (9)
(9)
рН = - lgC(T), где T–титрант, сильная кислота
1) расчёт pH исходного раствора
pH1 = 14 – 0,5(4,76+1) = 11,12
2) до ТЭ
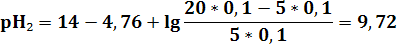

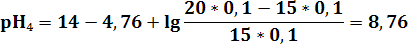

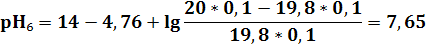

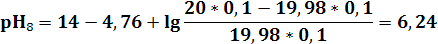
3) в ТЭ pH9 = 7 - 0,5(4,76 – 1,3) = 5,27
4) после ТЭ величина pH раствора определяется концентрацией С(T) избыточного титранта – сильной кислоты
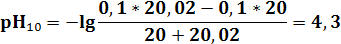

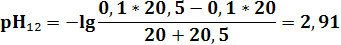




ТЭ лежит в слабокислой среде при рН = 5,27. Величина скачка титрования от рН = 7,5 до рН = 3. Подходят Ind: метил-оранжевый (рТ = 4), метил-красный (рТ = 5,5). Фенолфталеин – нельзя.
| V(HCl) | 19,8 | 19,9 | 19,98 | 20,02 | 20,1 | 20,5 | ||||||||||
| pH | 11,12 | 9,72 | 9,24 | 8,76 | 7,96 | 7,65 | 6,94 | 6,24 | 5,27 | 4,3 | 3,6 | 2,91 | 2,61 | 1,95 | 1,7 | 1,56 |

|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 363; Нарушение авторских прав?; Мы поможем в написании вашей работы!