
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства растворов ВМС
|
|
|
|
Высаливание – уменьшение растворимости и выделение полимера из раствора при добавлении электролитов (солей). Минимальная концентрация электролита, вызывающая высаливание, называется порогом высаливания. Порог высаливания зависит от рН и природы аниона
SO42– > F– > CrO4– > CH3COO– > Cl– > Br– > I– > SCN– ;
Коацервация – расслаивание раствора ВМВ при добавлении соли ниже порога высаливания. Происходит образование двух фаз – полимер в воде и вода в полимере. Коацерват может распределяться в растворе в виде капель и флоккул (соединенных между собой капель).

Рис. 1. Коацервация
Застудневание – переход раствора ВМС в гель (студень). В студне имеется структура, поддерживаемая межмолекулярными контактами. Застутневание зависит от концентрации ВМС, от температуры, рН, присутствия электролитов.
Тиксотропия – обратимое изменение структуры и механических свойств раствора ВМС при механическом воздействии без изменения температуры. Структурированный раствор полимера после перемешивания определенное время остается жидким, затем структура восстанавливается и раствор снова переходит в гель.
Синерезис – выделение жидкости из студня в результате структурообразования.
Осмотическое давление растворов ВМС низкое, и с трудом поддается точному измерению из-за влияния примесей электролитов. Было установлено, что зависимость осмотического давления от концентрации содержит 2 слагаемых (уравнение Галлера).
Пусть в 1 л раствора содержится m г полимера: c = m/M
p = cRT + bc 2 = mRT / M + bm 2/ M 2
Делим левую и правую часть уравнения на массу ВМС:

Параметр b зависит от формы молекул; в случае изодиаметрических молекул b = 0, и уравнение переходит в обычное уравнение Вант-Гоффа.

Рис. 2. Зависимость осмотического давления раствора ВМВ от массовой концентрации.
Полиэлектролиты. Электрофорез. Белки амфотерные полиэлектролиты, так как имеют на поверхности глобулы кислотные и основные группы.

Рис. 3. Схема молекулы полиэлектролита.
На молекуле постоянно имеются заряды, хотя в сумме они могут дать 0. Это зависит от рН среды. Значение рН, при котором молекула не заряжена, называется изоэлектрической точкой, рНI. При повышении рН молекула теряет протоны и приобретает отрицательный заряд. При электрофорезе она движется к аноду. При понижении рН ниже рНI основные группы связывают протоны, и на молекуле появляется положительный заряд. Молекула движется к катоду. При рН изоэлектрической точки молекула не подвержена электрофорезу. Методом электрофореза белки можно разделять по заряду. В изоэлектрической точке у белка минимальное набухание.
|

Рис. 4. Определение изоэлектрической точки по набуханию

Рис. 5. Разделение белков методом электрофореза
Мембранное равновесие Доннана – неравномерное распределение низкомолекулярного электролита в присутствии высокомолекулярного электролита.
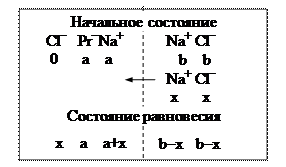
Рис. 6. Перенос ионов соли через мембрану
Условие равновесия состоит в том, что произведения концентраций Na+ и Cl– одинаковы справа и слева от мембраны:
x(a + x) = (b – x)2, откуда получаем

Анализ: при а=0 х= b/2 – это понятно, вещество NaCl распределится поровну.
Вязкость – это свойство жидкостей противостоять сдвигу, то есть возникновению течения. Подвижность, растекаемость типичных жидкостей говорит об их малой вязкости. Жидкости с большой вязкостью – это масла, мед, битум (вар). Коэффициент вязкости определяется следующей формулой:
F =–hS ;
;  ;
; 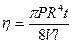 ;
;
Через капилляр длиной l и радиусом R протекает объем жидкости V за время t под давлением жидкости р = r gl. Обычно используют капилляры радиусом около 2×10–4 см.
Коэффициент вязкости воды 0,001; крови 0,0015; глицерина 1,49 Нс/м2 (в 1000 раз больше, чем крови).

Рис. 7. Вискозиметр
Относительная вязкость. h – раствор, hо – растворитель.
 ; t – время истечения.
; t – время истечения.
Удельная вязкость. hудельн = hотн – 1 = (h – hо )/hо .
Приведенная вязкость hприв = hудельн / с.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 2636; Нарушение авторских прав?; Мы поможем в написании вашей работы!