
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Занятие № 24. Адсорбционные процессы
|
|
|
|
Занятие № 24. Адсорбционные процессы
ЛЕКЦИЯ
Вопрос №2 События
События – это процедуры, которые выполняются всякий раз, когда это событие происходит. Например, событие OnChange компонента Edit происходит всякий раз, когда меняется текст в поле ввода. События находятся на вкладке Events Инспектора объектов. Если мы ничего не создадим, то при наступлении этого события ничего и не произойдет. Однако, если мы дважды щелкнем мышью по этому событию – создастся процедура обработки этого события. И тот программный код, который мы введем, будет выполняться всякий раз, когда это событие происходит.
Событие OnChange применяют довольно часто, когда нужно проверить правильные ли данные вводит пользователь. Хорошая новость – большинство событий (а также свойств и методов), у большинства компонентов одинаковы. Например, практически любой компонент для ввода пользователем текста имеет событие OnChange. Применяете ли вы Edit или Memo, это событие работает одинаково.
по учебной дисциплине "Тепло-массообменное оборудование предприятий"
(к учебному плану 200__г)
Разработал: к.т.н., доцент Костылева Е.Е.
Обсуждена на заседании кафедры
протокол № _____
от "_____" ___________2008 г.
Казань - 2008 г.
Учебные цели:
1. Изучить адсорбционные процессы и установки, принципиальные схемы адсорбционных процессов. Основы расчета адсорберов.
Вид занятия: лекция
Время проведения: 2 часа
Место проведения: ауд. ________
Литература:
1. Тепломассообмен: Учебное пособие для вузов / Ф.Ф. Цветков, Б.А. Григорьев. - 3-е издание. М.: Издательский дом МЭИ, 2006. – 550 с.
Учебно-материальное обеспечение:
Плакаты, иллюстрирующие учебный материал.
Структура лекции и расчет времени:
| № п/п | Структура занятия | Время, мин. |
| 1. 2. 3. | Повторение пройденного материала на лекции №23 Учебные вопросы: 1. Адсорбционные процессы и установки. Принципиальные схемы адсорбционных процессов. 2. Основы расчета адсорберов. Заключение |
1. АДСОРБЦИЯ, АДСОРБЦИОННЫЕ ПРОЦЕССЫ
Адсорбция - процесс поглощения газов (паров) или жидкостей, поверхностью твердых тел (адсорбентов). Явление адсорбции связано с наличием сил притяжения между молекулами адсорбента и поглощаемого вещества. По сравнению с другими массообменными процессами адсорбция наиболее эффективна в случае малого содержания извлекаемых компонентов в исходной смеси.
Различают два основных вида адсорбции: физическую и химическую (или хемосорбцию). Физическая адсорбция вызывается силами взаимодействия молекул поглощаемого вещества с адсорбентом (дисперсионными или ван-дер-ваальсовскими). Однако молекулы, соприкасаясь с поверхностью адсорбента, насыщают его поверхность, что ухудшает процесс адсорбции. Химическая адсорбция характеризуется химическим взаимодействием между средой и адсорбентом, что может образовывать новые химические соединения на поверхности адсорбента. Оба вида адсорбции экзотермичны. Однако если теплота физической адсорбции промышленных газов и паров соизмерима с их - теплотой конденсации (85-125 кДж/кмоль),- а в случае растворов даже меньше, то теплота химической адсорбции достигает нескольких сотен килоджоулей на киломоль. Химическая адсорбция протекает обычно с небольшой скоростью и возможна при высоких температурах, когда физическая адсорбция ничтожно мала.
Переход вещества из газовой и жидкой фаз в адсорбированное состояние связан с потерей одной степени свободы, т. е. сопровождается уменьшением энтропии и энтальпии системы, следовательно, выделением теплоты. При этом различают дифференциальную и интегральную теплоты адсорбции; первая выражает количество выделяющейся теплоты при поглощении очень малого количества вещества (2 г/100 г адсорбента), вторая - при поглощении до полного насыщения адсорбента. Повышение температуры в каждом процессе адсорбции зависит от теплоты адсорбции и массовой скорости газового (парового) потока, от температуропроводности этого потока и адсорбента, количества адсорбированного вещества и его концентрации. Так как адсорбционная способность адсорбента снижается с ростом температуры, экзотермичность процесса должна учитываться в инженерных расчетах. При больших тепловыделениях прибегают к охлаждению слоя адсорбента.
Процессы адсорбции отличаются избирательностью и обратимостью, позволяя поглощать (адсорбировать) из газовых (паровых) смесей и растворов один или несколько компонентов, а затем в других условиях выделять (десорбировать) их из твердой фазы. При этом избирательность зависит от природы адсорбента и адсорбируемых веществ, а предельное удельное количество поглощаемого вещества зависит еще от его концентрации в исходной смеси и температуры, а в случае газов - также от давления.
Адсорбенты - пористые тела с сильно развитой поверхностью пор. Удельная поверхность пор может достигать 1000 м2/г. Адсорбенты применяют в виде таблеток или шариков размером от 2 до 6 мм, а также порошков с размером частиц от 20 до 50 мкм. В качестве адсорбентов используют активированный уголь, силикагель, алюмосиликаты, цеолиты (молекулярные сита) и др. Важной характеристикой адсорбентов является их активность, под которой понимают массу адсорбированного вещества на единицу массы адсорбента в условиях равновесия. Активность адсорбента равна
а=М/G, (1)
где М - масса поглощенных компонентов; G - масса адсорбента.
Адсорбенты характеризуются также временем защитного действия, под которым понимают время, в течение которого концентрация поглощаемых веществ на выходе из слоя адсорбента не изменяется. При большем времени работы адсорбента происходит проскок поглощаемых компонентов, связанный с исчерпанием активности адсорбента. В этом случае необходима регенерация или замена адсорбента.
Достижению равновесия между твердой и подвижной газовой фаза
ми соответствует поглощение максимального количества вещества. Условия равновесия описываются в виде зависимости поглощающей способности (количества вещества М, поглощаемого единицей массы или объема адсорбента) от температуры Т и концентрации С поглощаемого вещества в равновесной подвижной фазе, т.е. М = f (Т, С). Обычно условия адсорбционного равновесия изучают при постоянной температуре. Зависимость М = f (G) называется изотермой адсорбции. Конкретная форма этой зависимости определяется свойствами и механизмом взаимодействия адсорбента и адсорбируемого вещества.
В связи с разнообразием адсорбентов и адсорбируемых веществ единая теория адсорбции пока не разработана. Закономерности процессов адсорбции, в которых определяющую роль играют ван-дер-ваальсовские силы притяжения, можно удовлетворительно описать так называемой потенциальной теорией адсорбции. Согласно этой теорий на поверхности адсорбента образуется полимолекулярный адсорбционный слой, энергетическое состояние молекул в котором определяется значением адсорбционного потенциала, являющегося функцией расстояния от поверхности, и не зависит от температуры. Наибольшее значение адсорбционный потенциал имеет, на поверхности адсорбента. Потенциальная теория применима к процессам адсорбции на адсорбентах, размеры пор которых соизмеримы с размерами поглощаемых молекул. В таких случаях происходит не послойное, а объемное заполнение пор.
Для описания процесса мономолекулярной адсорбции наибольшее применение получила теория Лангмюра, согласно которой за счет некомпенсированных сил у поверхностного атома или молекулы адсорбента адсорбированная молекула удерживается некоторое время на
поверхности. Адсорбция происходит в особых точках поверхности - центрах адсорбции. Материальные потоки, участвующие в процессах адсорбции и десорбции, содержат переносимые и «инертные» компоненты. Под первыми понимаются вещества, переходящие из одной фазы в другую, а под вторыми - те которые в таком переносе не участвуют. В твердой фазе «инертным» компонентом является адсорбент.
Скорость процесса адсорбции зависит от условий транспорта адсорбируемого вещества к поверхности адсорбента (внешний перенос), а также от переноса адсорбируемого вещества внутрь зерен адсорбента (внутренний перенос). Скорость внешнего переноса определяется гидродинамической обстановкой процесса, а внутреннего - структурой адсорбента и физико-химическими свойствами системы.
2. УСТРОЙСТВО АДСОРБЕНТОВ И СХЕМЫ АДСОРБЦИОННЫХ УСТАНОВОК
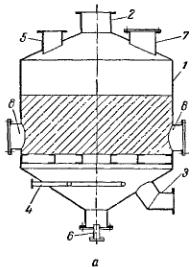
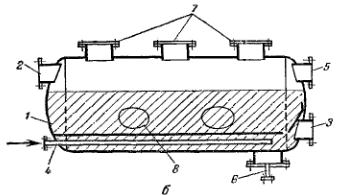
Процессы адсорбции проводятся в, основном следующими способами: 1) с неподвижным слоем адсорбента;
2) с движущимся слоем адсорбента;
3) с псевдоожиженным слоем адсорбента.



|
|




|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 974; Нарушение авторских прав?; Мы поможем в написании вашей работы!