
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Анод: надлишок електронів Катод: нестача електронів
|
|
|
|
Активний метал малоактивний метал
ЕЛЕКТРОХІМІЧНІ ПРОЦЕСИ
Лекція 12
В окисно-відновній реакції відбувається перехід електронів від одних атомів або іонів до інших. При цьому енергія хімічної реакції перетворюється в теплоту.
Проведемо такий дослід. Якщо занурити металеву пластину в розчин, що містить іони того ж металу, атоми з кристалічної гратки переходять в розчин і утворюють гідратовані іони металу. В той же час має місце і зворотний процес – гідратовані іони отримують електрони на електроді і утворюють атоми металу. Врешті-решт на електроді встановлюється рівновага:
Таким чином, між металом (електродом) і оточуючим його водним середовищем створюється якась різниця потенціалів, яку прийнято називати електродним потенціалом.
Електродний потенціал, відповідний стану рівноваги, при якій швидкість переходу іонів в розчин дорівнює швидкості їх зворотного осадження, називається рівноважним електродним потенціалом.
Метали відрізняються один від одного своєю здатністю переходити у вигляді іонів у водне середовище, тому при зануренні різних металів в розчини їх йонів величини виникаючих потенціалів різні (малюнок)
Виникнення електродного потенціалу
| Диполі води витягають іони металу в розчин, на електроді залишається надлишок електронів | Іони металу з розчину включаються в кристалічну гратку металу, навкруги електроду надлишок іонів |
Чим активніше метал, тим більше іонів він передає в оточуюче середовище і тим більше величина негативного заряду, що виникає на металевій пластинці. Проте у всіх випадках концентрація іонів металу в розчині мала.
Метал може розчинятися лише в тому випадку, якщо рівновага електродного процесу зміщена або зміщується у бік окиснення металу. Зсув рівноваги може бути досягнутий відведенням електронів від металевої пластинки. Такі умови створюються в гальванічних елементах.
В гальванічних елементах хімічна енергія перетворюється на електричну.
Найпростіший приклад гальванічного елемента – елемент Якобі-Даніеля, який складається з мідної і цинкової пластинок, занурених в розчини їх сульфатів:
Анод «-» Zn| ZnSO4|| CuSO4| Cu «+» Катод
Потрібно розрізняти знаки на електродах і їх назви
Елемент Якобі-Даніеля
процес окиснення процес відновлення
На межі кожного металу з розчином електроліту виникає різниця потенціалів, яка називається електродним потенціалом.
Електрод, на якому відбувається окиснення, називається анодом, а електрод, на якому відбувається процес відновлення – катодом.
Очевидно, чим більше різниця потенціалів, що виникає на межі розділу фаз «метал-розчин», тим більше відмінність в хімічній активності металів, тим більш енергійно буде перебігати реакція окислення-відновлення.
Для порівняння хімічної активності металів складають такі гальванічні елементи, в яких один електрод є стандартним.
Як стандартний електрод застосовують нормальний водневий електрод.
Це платинова пластинка, покрита шаром мілкодисперсної платини, що занурена в розчин 1М Н2SO4. Через цей розчин під тиском в 1 атм. пропускається газоподібний чистий водень при температурі 250С. Водень поглинається платиною. З водневого електроду, так само, як і з металевого, в розчин переходять позитивні іони (Н+). Внаслідок цього між насиченою воднем платиною і розчином сірчаної кислоти виникає різниця потенціалів, яка умовно приймається рівній нулю.
Щоб виміряти електродний потенціал якого-небудь металу, складають гальванічний елемент із стандартного водневого електроду і випробовуваного електроду.
Різниця потенціалів, що виникає в гальванічному елементі, що складається з нормального водневого електроду і випробовуваного металу, називається нормальним (або стандартним) електродним потенціалом металу.
Нормальні потенціали металів можуть служити кількісною характеристикою їх відновній здатності, тобто здібності віддавати електрони.
По своїй хімічній активності метали розташовуються в ряд, який називається рядом напруг або рядом активностей металів.
| Li | К | Ca | Na | Mg | Al | Ti | Mn | Cr | Zn | Fe | Cd | ||||||||
| -3,05 | -2,92 | -2,87 | -2,71 | -2,36 | -1,66 | -1,63 | -1.18 | -0.91 | -0.76 | -0.44 | -0.40 | ||||||||
| Ni | Sn | Pb | Cu | Hg | Ag | Pt | Au | ||||||||||||
| -0.25 | -0.14 | -0.13 | 0,34 | 0.79 | 0,80 | 1.19 | 1.50 | ||||||||||||
1. Кожний метал здатний витісняти з розчинів солей всі метали, що знаходяться у ряді напруг праворуч від нього, тобто метали, що мають алгебраічно більшу величину електродного потенціалу.
2. Водень з розбавлених кислот може бути витиснений тільки металами, нормальні електродні потенціали яких мають негативний знак.
3. Чим менше алгебраічна величина електродного потенціалу, тим більше відновна здатність атома металу і навпаки, тим менше окисна здатність його іона.
4. В гальванічному елементі за негативний електрод приймають більш активний метал, тобто метал, електродний потенціал якого має меншу величину.
Знаючи Е0, можна обчислити електрорушійну силу (ЕРС) гальванічного елемента.
ЕДС гальванічного елемента визначається шляхом віднімання від більш позитивного потенціалу системи більш негативного:
Наприклад, для елемента Якобі-Даніеля (Zn-Cu):
ЕДС = 0,34-(-0,76)=!,10 В.
Величина електродного потенціалу залежить від природи речовини, концентрації його окисленої і відновленої форм, температури. Ця залежність виражається за допомогою рівняння Нернста:
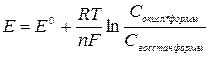

Е – величина електродного потенціалу
Е0 – величина стандартного електродного потенціалу;
R – універсальна газова постійна, 8,31 Дж/моль*К;
n – кількість електронів, що беруть участь в реакції;
T – температура;
F – число Фарадея (96500 Кл).
Для температури 250С, якщо підставити всі константи і замінити натуральний логарифм на десятковий, отримаємо:

з рівняння Нернста можуть бути розраховані концентрації окисленої і відновленої форм речовини, число електронів, що беруть участь в реакції.
Якщо в рівняння входить СМе, тобто відновлення відбувається до металу, то ця величина як константа входить в значення рівноважного потенціалу.
Відомо, що реакції окислення-відновлення йдуть у бік утворення більш слабого відновника і більш слабого окисника.
Для визначення напряму окисно-відновних реакцій необхідно керуватися наступними правилами:
1. Окислена форма системи з більш позитивним потенціалом завжди є окисником, відновлена форма системи з більш негативним потенціалом завжди є відновником.
2. Якщо різниця потенціалів реагуючих систем (тобто ЕРС) виявляється позитивною (спочатку береться потенціал окисника, а потім потенціал відновника), то реакція в даному напрямі йде (тобто в прямому напрямі).
Наприклад: 1)
2)
3)
коефіцієнти не враховуються
Значення стандартних електродних потенціалів для різних систем наводяться в довідкових таблицях.
На знанні процесів окислення-відновлення побудовані закони електролізу.
Електроліз – це окисьно-відновний процес, що протікає при проходженні електричного струму через розчин електроліту або його розплав. Цей процес супроводиться перетворенням електричної енергії в хімічну.
Якщо у водний розчин електроліту опустити електроди, сполучені з джерелом постійного струму, то безладний рух іонів, що знаходяться в розчині, стає направленим: позитивно заряджені катіони починають переміщатися до катода, а негативно заряджені аніони – до анода.
В результаті на катоді створюється надлишок електронів, а на аноді – їх нестача. З катода електроди переходять до позитивних іонів і перетворюють їх на нейтральні атоми (катодні осади металів). Негативні іони, підійшовши до анода, віддають йому свої електрони і також розряджаються.
Таким чином, електроліз полягає в тому, що на катоді відбувається процес відновлення, а на аноді – окиснення.
 Розглянемо як приклад, електроліз водного розчину хлориду міді:
Розглянемо як приклад, електроліз водного розчину хлориду міді:
анод 2Cl - - 2е = Сl2 окиснення
катод Си2+ + 2е = Сu відновлення
Розглядаючи ряд напруг металів, бачимо, що чим менше стандартний електродний потенціал металу, тим слабіше окисна здатність його іонів, тобто здатність приєднувати електрони і перетворюватися на нейтральні атоми.
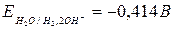 . Отже, при пропусканні електричного струму через водні розчини солей металів, що мають більш негативний потенціал, на катоді повинні відновлюватися не іони металу, а молекули води.
. Отже, при пропусканні електричного струму через водні розчини солей металів, що мають більш негативний потенціал, на катоді повинні відновлюватися не іони металу, а молекули води.
Електроліз розчину NaCl:
 NaCl
NaCl
Cl - Na+
анод 2Cl - - 2е = Сl2 окиснення 2H2O + 2e = H2 + 2OH – відновлення
Молекули води відновлюються тільки при електролізі водних розчинів солей дуже активних металів, розташованих у ряді напруг від калія до алюмінію включно.
Процес електролізу підкоряється законам Фарадея:
1. Кількість речовини, що виділяється на електроді, прямо пропорціонально кількостіелектрики, що пройшла через розчин (або розплав).
m ~I·t
2. При пропусканні однакової кількості електрики через розчини різних електролітів кількості речовин, що виділяються на електродах, пропорційні їх еквівалентам. Для виділення одного еквіваленту речовини потрібно 96497 Кл електрики.
Загальна формула, якщо I·t = 1 Кл, то m=Э/96497=Е
де Е – електрохімічний еквівалент
Величина виходу за струмом: дозволяє визначити, наскільки повно пройшов електроліз
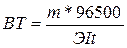
За допомогою електролізу одержують з розплавів галогенідів лужні і лужноземельні метали.
Електролізом проводиться електрорафінування (очищення) міді і цинку.
За допомогою електролізу наносяться різні захисні покриття металами (гальванопокриття) або оксидами (анодування).
Електрофорез – міграція заряджених колоїдних частинок в електроліті під дією струму.
Електродіаліз – відділення колоїдних частинок від електролітів або молекулярних частинок від дисперсійного середовища (штучна нирка).
Гальванічний елемент
Це первинне хімічне джерело струму або гальванічний елемент одноразової дії.
Пристрій найпростішого гальванічного елемента: анод – цинкова упаковка; катод – графітний стрижень, покритий шаром манган диокису і вуглецем; електроліт – паста з хлориду цинку, хлориду амонія і води.
Реакції: на аноді: Zn → Zn2+ + 2e;
на катоді: 2MnO2 тв.+ 2NH4+водн. +2е → Mn2O3 тв.+ 2NH3 водн. + Н2Ор.
Напруга від 1,25 до 1,50 В.
Свинцевий аккумулятор
Це вторинне джерело струму, що здатне перезаряджатися. Напівреакції легко оборотні: анод – свинець; катод – свинцеві грати, набиті PbO2; електроліт – розчин сульфатної кислоти.
Реакції: на аноді: Pbтв. + SO4 2- → PbSO4 + 2e розряд →
на катоді: PbO2 тв. + 4Н+ + SO4 2- + 2e → PbSO4 + 2H2O заряд ←
напруга 2В, в автомобілі 6 акамуляторів – 12В.
Приклад розрахунку потенціалу електроду в розчині його солі: мідний електрод в 0,01 М розчині CuSO4:
по рівнянню Нернста:
Приклад розрахунку ЕДС гальванічного елемента:
Cd (Ecd/Cd = -0,40 В) в розчині 0,01 М CdSO4
Ag (EAg/Ag = +0,80 B) в розчині 0,1 М AgNO3
анод «-» Cd │CdSO4││ AgNO3 │Ag «+» катод
кадмієвий електрод – джерело електронів, що поступають в зовнішній ланцюг – вважається негативним, а мідний електрод – позитивним.
Потрібно розрізняти знаки електродів і їх назви. Назви даються відповідно до процесів, які на електродах протікають: там, де йде окиснення – анод (Cd), а там, де йде відновлення – катод (Ag).
Чому буде рівний при рН = 7?
Приклади електролізу
1. катод (Pt, З) розплав NaCl анод (Pt, З)
2. електроліз водних розчинів протікає складніше:
катод розчин NaCl анод
Механізм розряду іонів при електролізі залежить від їх концентрації, рН, густини струму.
Катодні процеси:
1. Катіони металів з позитивним електродним потенціалом відновлюються практично повністю (від Си2+ до Pt4+)
2. Катіони металів від Li+ до Al3+ з дуже малим електродним потенціалом не відновлюються, замість них розряджаються молекули води
3. Катіони металів від Al3+ до Н+ при електролізі відновлюються разом з молекулами води.
Анодні процеси:
Бувають нерозчинні (інертні) і розчинні аноди.
Інертні: графіт, платина, іридій при електролізі не змінюються, на них окиснюються аніони і молекули води. Аніони безкисневих кислот (
) окиснюються; у разі аніонів кисневмісних кислот (
) окиснюється вода.
Розчинні: цинк, кадмій, срібло, нікель.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1596; Нарушение авторских прав?; Мы поможем в написании вашей работы!