
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методи добування
|
|
|
|
1. взаємодія насичених вуглеводнів з галогенами(під дією світла):
R-Cl +NaI→ R-I+NaCl
2. заміщення в молекулах спиртів гідроксильної групи на галоген.(присутність H2SO4):
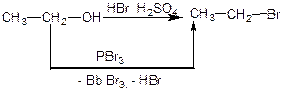
3. з оксосполук, з альдегідів та кетонів:
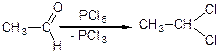
4. з ненасичених сполук прєднанням галогенводнів та галогенів:
Алкілофториди отримують звичайними методами:
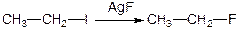
Розчинність йодиду > розчинності фториду.
3. Фізичні властивості. Галогеналкани мають характерний запах і багато з них діють як наркотики. У воді галогенпохідні насичених вуглеводнів майже не розчинні, але легко розчиняються в органічних розчинниках, таких як спирт, ефір. Самі галогеналкани є добрими розчинниками для багатьох органічних сполук. Нижчі галогеналкани – газоподібні речовини, середні- безбарвні рідини, вищі – тверді речовини жовтого кольору.
Із збільшенням вуглеводневого радикала і атомної маси галогену, який входить до складу молекули, температура кипіння галогеналканів підвищується. При збільшенні атомноїх маси галогенів зростае також і відносна густина цих речовин(I>Br>Cl). Відносна густина F- та Cl- похідних в більшості випадків <1, Br та I > 1.
В ІЧ-спектрах галогеналканів смуга валентних коливань зв'язку C-F знаходиться в інтервалі 1000-1350 см-1, зв' язку C-Cl близько 600-800см-1, зв'язків C-Br і C-I близько 500-600см-1.
В ПМР-спектрах галогеналканів різні протони дають різні зсуви. Протони, які знаходяться біля атома вуглецю, сполученого з атомом галогену також дають різні хімічні зсуви. Так, в хлоралканах R- CH2-Cl ці зсуви характеризуються величиною 3,7 млн-1, у бромалканах R-CH2-Br вони мають значення 3,5 млн-1, у йодалканах R-CН2-І-3,2 млн-1.
4. Хімічні властивості. Галогеналкани – одні із найбільш реакційноздатних органічних речовин. Більшість реакцій цих речовин відбувається з участю атома галогену. Зв'язок між атомом вуглецю і атомом галогену ковалентний. Але галоген більш електронегативний, ніж вуглець. Тому електронна пара зв'язку C→ Hal значно зміщена до атома галогену. Внаслідок цього зв'язок поляризується і атом галогену має заряд δ-, а атом вуглецю- заряд δ+. Поляризація зв'язку C→ Hal передається на сусідні C-C і C-H-зв'язки. Внаслідок цього електронна густина цих зв'язків зміщується в бік атома галогену.
Отже, атом галогену в молекулах галогеналканів виявляє негативний індукційний ефект(-І), який затухає в міру віддалення від цього атома.
Молекули галогеналканів мають значну полярність, оскільки містять полярні зв'язки C- Hal, які мають певні дипольні моменти.
Характеристика зв'язківC- Hal у молекулах галогеналкнів:
| Зв'язок | Електро-негатив-ність галогену | Радіус Атома галогену, нм | Енергія зв'язку, кДж/моль | Поляризація зв'язку,см3 | Довжина зв'язку l, нм | Дипольний момент, D |
| С-F C-Cl C-Br C-I | 4,0 3,0 2,8 2,5 | 0,064 0,099 0,114 0,133 | 429,24 332,64 278.04 220,08 | 1,7 6,5 9,6 14,6 | 0,142 0,177 0,191 0,212 | 1,4 1,5 1,4 1,2 |
Збільшення радіуса атома галогену зумовлює зростання між'ядерної віддалі l зв'язку С- Наl. Внаслідок цього енергія зв'язку в ряду С-F, C-Cl, C-Br, C-I зменшується. Найменшу енергію має зв'язок С-І, тому в хім. Реакціях він найактивніший. Отже зв'язки С- Hal за хім. Активністю розміщуються в ряд:
С-I > C-Br > C-Cl > C-F.
Для галогенпохідних насичених вуглеводнів найхарактернішими є реакції заміщення галогену(нуклеофільне заміщення SN) і реакції відщеплення (Е).
Галоген, сполучений з атомом вуглецю, є слабкою основою. Його у вигляді іона можна легко замінити на сильнішу основу. Тому для галогеналканів характерними є реакції нуклеофільного заміщення (SN). При нуклеофільному заміщенні нуклеофіл атакує молекулу і надає для утворення нового зв'язку свої електрони. Електрони зв'язку, який розривається, відходять разом з іоном, який при цьому утворився.
Швидкість заміщення атомів галогенів у молекулах галогеналканів досить різна і залежить від будови вуглеводневого радикала, з яким сполучений атом галогену. А також від природи галогену, нуклеофілу і розчинника.
У реакції SN-заміщення найбільш активніші йодпохідні. Фторпохідні практично нереакційноздібні.
1. Гідроліз галогенпохідних:

2. Взаємодія зі спиртами та алкаголятами:

3. Взаємодія з амінами(реакція Гофмана):

4. Взаємодія зі солями синільної кислоти (утворюються нітрильні похідні):


5. Реакція Фінкільштейна (один галоген заміщуе інший):

Первинні галогеналкани:
CH3Br: швидкість гідролізу пропорційна як до концентрації галогеналкану, так і до концентрації [OH-]:
SN (2):

Третинні галогеналкани:
Реакція гідролізу залежить тільки від концентрації галогеналкану.
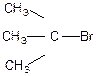
Бромістий ізобутил:
Вторинні галогеналкани (змішаний механізм):
SN (1):

SN (2):

По здібності до SN-заміщення найбільшреакційноздібними є йодпохідні, найменш – хлорпохідні.
Нуклеофільна активність реагентів:
HOH<Cl-<Br-<OH-<C2H5O-<NH2
Найбільш сильним реакційним агентом є карб-аніон. Збільшенню полярності і сольватуючої здібності розчинника сприяє реакція SN(1)-заміщення.
Реакція відщеплення:
Реакція SN часто супроводжується реакціями відщеплення. Як і реакції заміщення, реакції відщеплення можуть перебігати як за Е(1), так і за Е(2)-механізмами. Реакції, які перебігають за механізмом Е(1) не потребують присутності реагента, але необхідна присутність йонизуючого розчинника і сольватуючих іонів.

Розгалуженість алкільної групи, збільшеність іонізуючої здібності розчинника, збільшення температури призводить до збільшення виходу олефіїнів.
Для перебігання Е2 необхідна присутність сильної основи.
Відношення продуктів заміщення та відщеплення залежить від активності основ. Чим більш активна основа, тим більший вихід олефіїнів.
- взаємодія з Металами (реакція Вюрца)

реактиви Гріньяр
На основі цих сполук получимо значну кількість класів органічних сполук (кетони, кислоти)
- реакція полімеризації
хлорвініл поліхлорвініл
застосовується в виробництві ізоляційних матеріалів; трубки в медицині.
Хлоропрен – синтез каучуків.
Перфторпохідні

в результаті полімеризації утворюється тефлон, хімічно стійкий.
Алкілгалогени дуже токсичні, їм властива наркотизуюча дія (хлороформ).
Дуже сильні немато- та гербоциди ДДТ.
Література
1. Степаненко Б.Н. Курс органической химии. (в 2-х частях), ч. 2. Карбоциклические и гетероциклические соединения. Учеб. для вузов. 6-е перер. и доп. М.: Высшая школа. 1981.
2. Тейлор Г. Основы органической химии для студентов нехимических специальностей./ пер. с англ. Е.Д./ М.: Мир. 1989.
3. Черных В.П., Зименковский Б.С., Гриценко И.С. Органическая химия. В 3-х томах. Харьков: Основа. 1993, 1995, 1998.
4. Домбровський А.В. Органічна хімія. Навч. посіб. – К.: Вища школа. 1991
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1029; Нарушение авторских прав?; Мы поможем в написании вашей работы!