
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сурет 1. Реакция өнімдерінің немесе қалдық газадардың жылуын қолдану.
|
|
|
|
Реакция өнімдерінің немесе қалдық газадардың жылуын қолдану.
1- Жылуалмастырғыш, 2-реакционды аппарат
Қоршаған ортаға түсетін жылулық шығындар 264/4390 *100 = 6% құрайды.
Химио–технологиялық процестердің бірқатарында жылулық шығындар 10-15% құрайды. Оларды аппаратуралардың жылулық изоляциялауын және аппартардың құрылымдық жабдықталуын азайтады.
Негізгі әдебиеттер 1 [284-301], 2 [40-55], 3 [55-66]
Қосымша әдебиеттер 8 [6,-67], 9 [30-45]
Бақылау сұрақтары:
1. Химиялық кәсіпорындарда қолданылатын энергия түрлері
2. Энергетикалық ресурстарының жіктелуі
3 Химиялық өндірістің энергия сыйымдылығы
4. Химиялық өндірістің жылу балансы.
№5 дәріс. Химио-технологиялық процестің негізгі кезеңдері мен заңдылықтары. Өндірістің химиялық кезеңдерінің жіктелінуі. Гомогенді және гетерогенді процестер. Айналудың теңсалмақты деңгейі және оны ұлғайту тәсілдері.
ХТ зерттеу нысаны болып химиялық өндіріс (ХӨ) табылады. Химиялық өндіріс – шикізатты өңдеуге арналған машиналар мен аппарттарда қажетті өнімдерге химиялық айналдыру жолымен жүзеге асатын процестер мен операциялардың жиынтығы. Химиялық өндіріске қойылатын талаптар:
1. Өндірісте қажетті өнімді алу.
2. Эколгиялық қауіпсіздік.
3. Пайдаланудын қауіпсізділігі және сенімділігі.
4. Шикізат пен энергияның максималды қолданылуымен.
5. Еңбектің максималды өнімділігі.
ХӨ негізгі міндеті – өнімді алу. ХӨ жалпы құрылымына бірінші – суретте көрсетілген функционалдық бөлшектері кіреді.
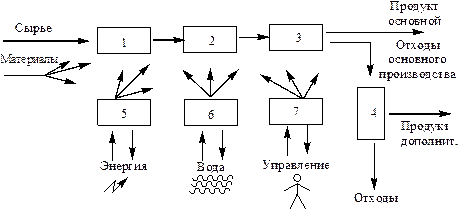
1- Сур. ХӨ құрылымы және функционадық элементтері. 1- шикізатты дайындау, 2- шикізатты өңдеу,3- негізгі өнімдерді бөліп алу, 4- қалдықтарды санитарлық тазалау және утилизация, 5- энергетикалық жүйе, 6- көмекші материалдарды даярлау және су дайындау, 7- басқару жүйесі.
ХӨ компоненттері. Ауыспалы компоненттер әрқашан өндірісте тұтынылады немесе түзіледі: өңдеуге түсетін шикізат, көмекші материалдар, өнімдер-негізгі және қосымша – шикізатты өңдеу нәтижесі ретінде. Өндіріс қалдықтары, өндірістің қызмет етуін қамтамасыз ететін энергия.
Тұрақты компоненттер өндіріске енгізіледі (құрал-жабдықтар, конструкциялар) немесе толық мерзім бойы оған қатысады: аппараттура (машиналар, аппараттар, сыйымды ыдстар, құбырлар, арматуралар), бақылау және басқару қондырғылары, персоналға (жұмыскерлер, аппараттшылар, инженерлер) қызмет ететін құрылыс конструкциялары (ғимарат, құрал-жабдықтар).
Химиялық өндірістің құрамы: химиялық өндірістің өзі шикізат, өнімдердің қоймасы; шикізат, өнімдер, аралық заттар, қалдықтарды тасымалдау; өндірістік салаларда қызмет ететін персонал; басқару, қамтамасыз ету және қауіпсіздік жүйелері.
Химио – технологиялық процесс (ХТП). ХТП –бастапқы заттарды өнімге айналдыратын мақсатты өңдеу процестерінің кезектілігі – химиялық және физико-химиялық процестердің кезектілігі. ХТП келесідей жеке процестер мен операциялардың түрлерін және олар жүзеге асатын аппараттар немесе машиналарды бөліп қарастырады: Механикалық және гидромеханикалық процестер – материалдардың орның ауыстыру олардың пішіні мен мөлшерлерін өзгерту, сығу және ұлғайту, ағындарды жылжыту және бөлу. Олардың барлығы өңделетін материалдың химиялық және фазалық құрамын өзгертпей-ақ жүреді.
Жылуалмасу процестері – қызу, салқындату, фазалық күйін өзгерту. Оларда химиялық және фазалық құрам өзгермейді.
Массаалмасу процестері - фаза аралық алмасу, оның нәтижесінде әсерлесетін фазалардың компоненттік құрамы оның химиялық құрамы өзгермей ауысады. Бұған еру, кристалдану, құрғату, дистильдеу, ректификация, абсорбция, экстракция, десорбция жатады.
Химиялық процестер – химиялық реакторларда химиялық құрамының толық өзгеруі.
Энергетикалық процестер – турбиналарда, генераторларда, моторларда энергияның (жылу, механикалық, электрлік) әр түрлі түрлерінің өзара ауысуы.
Басқару процестері – ағындар мен заттардың, олардың күйінің өзгеруінің жағдай туралы ақпараттарды алу және жіберу.
Кез келген өндіріс процестерінің тәжірибиелік мақсаттылығы және рентабельділігі технико-экономикалық көрсеткіштермен сипатталады. ХТЖ көрсеткіштері: техникалық, экономикалық, әлеуметтік.
Гомогенді және гетерогенді процестер.
Гомогенді деп біртекті ортада жүретін химиялық процестерді атайды, яғни бөлгіш беттері жоқ сұйық немесе газтәрізді қоспаларда. Гомогенді процестің жалпы жылдамдығы химиялық айналымның кинетикасымен анықталады.
Реакцияның м о л е к у л я р л ы ғ ы бойынша моно-, би- және тримолекулярлы, қатары бойынша – нольдік, біріншілік, екіншілік, үшіншілік және бөлшектік қатарлар болып бөлінеді. Моно молекулярлы реакцияларға молекула ішілік топтар А → D (изомеризлену, инверсия)және ыдырау реакциялары A → D + R жатады. Бимолекулярлы реакциларқосылу реакциялары А + А → А • А немесе А + В → АВ, ыдырау 2А → D + R және орынбасу(алмасу) А + ВС → АВ + С немесе АВ + CD → АС + BD болып бөлінеді. Үшмолекулярлы реакцияларсалыстырмалы түред сирек кездеседі; олар әдетте көп кезеңді болады. Үшмолекулярлыға қосылу, алмасу, реконбинация реакциялары болуы мүмкін, яғни сәйкесінше
ЗА → D; 2А + В → D + R и A + B+C→D+R+…
Жауап қайтаратын заттардың концентрацияларының химиялық реакция жылдамдығына әсері жалпы жағдайда келесі теңдеумен сипатталады u = k∆C, бұл жерде u G өнімінің, санының өзгерісі арқылы көрсетілуі мүмкін, концентрацияларының немесе уақыт бойынша айналу деңгейлерінің көлемінің өзгеруі арқылы көрсетілуі мүмкін, яғни 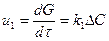 ,
, 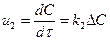 немесе
немесе 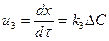 , мұндағы ∆ реакцияның ретіне және қайтымдылығына, араласу деңгейіне байланысьы әр түрлі анықталады.
, мұндағы ∆ реакцияның ретіне және қайтымдылығына, араласу деңгейіне байланысьы әр түрлі анықталады.
А -> В + D схемасы бойынша жүретін бірінші ретті қайтымсыз реакцияның жылдамдығы әсерлесуші заттың концентрациясына тура пропорционалды және 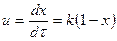 (1), теңдеуімен көрсетіледі, егер процесс периодтық әсерлі ығыстыру реакторларында немесе кез келеген аппаратарда жүзеге асырылатын болса.
(1), теңдеуімен көрсетіледі, егер процесс периодтық әсерлі ығыстыру реакторларында немесе кез келеген аппаратарда жүзеге асырылатын болса.
Бірінші ретті қайтымды реакцияның кинетикалық теңдеуі күрделірек болып келеді, өйеткені тікелей және қайтымды реакцияның жылдамдылығы есептелінеді мысалы, тиоцианат пен тиомочивинаның өзара айналу реакциясы NH4SCN ↔ (NH2)2SC, жалпы түрде 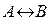 ретінде көрсетуге болады. Реакция біруақытта кері және тікелей бағыттарда жүретіндіктен, онда оның жылдамдығы тікелей және кері реакциялардың жылдамдарының айырымына тең, олардың әрқайсысы мономолякуларлы болып табылады. Идеалды ығыстыру реакторы үшін жылдамдық теңдеуі
ретінде көрсетуге болады. Реакция біруақытта кері және тікелей бағыттарда жүретіндіктен, онда оның жылдамдығы тікелей және кері реакциялардың жылдамдарының айырымына тең, олардың әрқайсысы мономолякуларлы болып табылады. Идеалды ығыстыру реакторы үшін жылдамдық теңдеуі 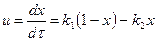 (2) түрінде. Теңбе- теңдік сәтінде теңдік константасы
(2) түрінде. Теңбе- теңдік сәтінде теңдік константасы 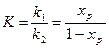 (3). (3) теңдеуін қолдана отырып, тікелей және кері реакциялардың жылдамдықтарының константасын есептеуге болады.
(3). (3) теңдеуін қолдана отырып, тікелей және кері реакциялардың жылдамдықтарының константасын есептеуге болады.
Екінші ретті қайтымсыз реакцияның А + В → С + D жылдамдығы да А және В әсерлесуші заттардың концетрациясына тура пропорционалды. Ығыстыру реакторы үшін 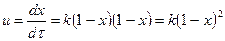 (4).
(4).
Үшінші ретті реакциялардың жылдамдығы А, В, D үш әсерлесуші заттардың концентрацияларына тура пропорционалды. Егер реагенттер эквиваленттік қатынаста алынса, онда
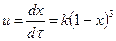 (5). Үшінші ретті реакциялардың аз жылдамдығының нәтижесінде практикалық қолданылуы аз болып келеді.
(5). Үшінші ретті реакциялардың аз жылдамдығының нәтижесінде практикалық қолданылуы аз болып келеді.
Гетерогенді химиялық процестерде бастапқы заттар мен өнімдер әр түрлі фазаларда болады. Газ (сұйық) қатты жүйесінде қатты реагент болып газ немесе сұйық ағындар мен шайылатын кесектік немесе дәндік материал болады. Бөлшектердің беті бірдей қолжетімді. Бөлшектердің мөлшерлері өзгеруі немесе өзгермеуі мүмкін, бастапқы қатты реагенттің орның басатын қатты өнім түзілсе.
Қатты бөлшектердің мөлшерін өзгертетін процестер. Бұның негізінде: Aг + Вт = Rг, реакциясы жатыр, мұндағы г және т компонентер фазасы.
Процестің құрылым келесі кезеңдермен көрсетілген: ағыннан беттік жазыққа А реагентін тасымалдау (бірінші І кезең). Сп жазықтығындағы А концентрациясы ағымға қарағанда аз болуы керек; бөлшектің сыртқы бетінде қатты В (ІІ кезең) бар А реакциясы; R өнімін беткі жазықтықтан ағындарға тасымалдау. Реакция жылдамдығы R концентрациясына тәуелді емес және жазықтықтан шығуы процеске әсер етпейді.
Қатты фазада: жазықтықта газтәрізді А мен В реакциясы (ІІ кезең); r бөлшектерінің мөлшерлерін өзгерту, кішірейту (III кезең).
Қатты реагент мөлшері кішіреетін мұндай гетерогенді процестің схемасын «қысушы сфера» деп атайды.
Процестің математикалық моделі: қатты бөлшекте заттардың көлемдік болуы газға қарағанда жүз есе көп. Бөлшектердің мөлшерлерін кішірейту жайырақ жүреді, моно мен шекаралық қабаттағы концентрациялардың таралуы жүреді. Сондықтан уақыттын әрбір сәтінде процестер газдық фазада стационарлық күйде деп есептеуге болады. Стационарлық режимде А заттарының беткі жазықтыққа ағыны (W1 –I кезең) және А әсерлесуінің жылдамдығы (W2 – II кезең) WI = WII тең (2). А ағыны Sr бөлшегінің жазықтығына пропорционалды және С0 ағынында Сп бөлшегінің жазығында А концентрациясының айырмашылығына пропорционалды: 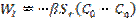 (3), мұндағы β - массалмасу коэффициенті. Жазықтықтағы А айналу жылдамдығы бөлшектің сыртқы жазықтығына пропорционалды:
(3), мұндағы β - массалмасу коэффициенті. Жазықтықтағы А айналу жылдамдығы бөлшектің сыртқы жазықтығына пропорционалды: 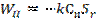 (4). 1 формулаға 3 пен 4 қоя отырып
(4). 1 формулаға 3 пен 4 қоя отырып 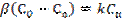 (5) аламыз.
(5) аламыз.
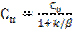 (6) жазықтығындағы А концентрациясы және бақыланатын айналу жылдамдығы
(6) жазықтығындағы А концентрациясы және бақыланатын айналу жылдамдығы 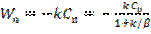 (7). k және β параметрлерінің комбинациясын Кн –жылдамдықтың бақыланатын константасы арқылы белгілейміз:
(7). k және β параметрлерінің комбинациясын Кн –жылдамдықтың бақыланатын константасы арқылы белгілейміз: 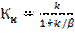 (8). Онда
(8). Онда 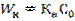 . (9). Тәжірибие жүзінде айналымды хВ қатты затының айналу деңгейі арқылы көрсету қолайлы. Уақытпен бірге айналу деңгейінің өзгерісі:
. (9). Тәжірибие жүзінде айналымды хВ қатты затының айналу деңгейі арқылы көрсету қолайлы. Уақытпен бірге айналу деңгейінің өзгерісі: 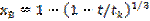 (10).
(10).
Уақыт бойынша бір бөлшектін айналу жылдамдығы келесі формуламен өзгереді: 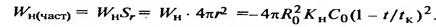 (11), мұндағы R0 бөлшектің бастапқы мөлшері, t – бөлшектін мөлшері r–ге дейін кішерейгендегі уақыт саты, tк – қатты бөлшек толығымен әсерлескендегі уақыт.
(11), мұндағы R0 бөлшектің бастапқы мөлшері, t – бөлшектін мөлшері r–ге дейін кішерейгендегі уақыт саты, tк – қатты бөлшек толығымен әсерлескендегі уақыт.
Қатты бөлшектің мөлшері өзгермей–ақ жүретін процесс. Оның негізінде: 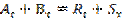 . Реакция бастапқы реагентер мен өнімдерімен қатты фазаларының бөліну шекарасында жүреді және бұл топохимияылқ процесс деп аталады. Мысалы, Н-р, H2S + ZnO = H2O + ZnS, 4FeS2 + 11O2 = 8SO2 + 2Fe2O3.
. Реакция бастапқы реагентер мен өнімдерімен қатты фазаларының бөліну шекарасында жүреді және бұл топохимияылқ процесс деп аталады. Мысалы, Н-р, H2S + ZnO = H2O + ZnS, 4FeS2 + 11O2 = 8SO2 + 2Fe2O3.
Процестің құрылымы келесі кезеңдерден тұрады:
Газтәрізді компонентер үшін:
1. бөлшектің жазықтығынан А компонентінің тасымалдануы (І кезең);
2. ядро жазықтығына инерт қабаты арқылы реагенттің тасымалданыу (ІІ кезең); инерт- борпылдақ материал. Компоненттін тасымалдануы тесіктер арқылы жүзеге асады;
3. ядро жазықтығындағы Вт бірге Аг реакциясы (ІІІ кезең).
Математикалық модель: Стационарлық режимде  ;
; 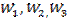 - процестің сәйкес кезеңдеріндегі А ағындары. R0 радиусты бөлшектің жазықтығына А ағыны:
- процестің сәйкес кезеңдеріндегі А ағындары. R0 радиусты бөлшектің жазықтығына А ағыны: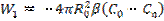 (12) есептелінеді. Инерт қабаты арқылы А тасымалы–
(12) есептелінеді. Инерт қабаты арқылы А тасымалы–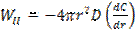 (13) Фика теңдеуімен сипатталатын диффузиялық процесс.
(13) Фика теңдеуімен сипатталатын диффузиялық процесс. 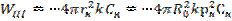 , (14) мұндағы ря – ядроның өлшемсіз радиусы р = r / R0.
, (14) мұндағы ря – ядроның өлшемсіз радиусы р = r / R0.
Wн бақыланатын айналым жылдамдығы мына формуламен есептелінеді: 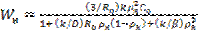 (15).
(15).
2. Газдардың өзара әсерлесуі– фазалардың әсер ету тәсілдері бойынша сұйық өнеркәсіпте бірнеше түрлілігіме көрсетіледі:
1. Барботаж (көпіршік түріндегі диспергерленген газ сұйықтық қабатына көтеріледі);
2. Суландыру (тамшы түріндегі диспергерленген сұйықтық газ арқылы ұшып кетеді);
3. Пленкалы ағын (сұйықтық жазықтық бойынша пленкалы ағады, газ ағыны оның қасынан өтеді);
4. Қондырма колонналарындағы қатынас (ретсіз түрде сұйықтық қондырма бойымен ағады. Газ еркін кеңістікте өтеді);
5. Газсұйықты ағын (газ және сұйықтық ағындары бір бағытта қозғалады).
Процестің құрылымы. Екі фаза да аққыш болғандықтан, фазалардың бөліну шегінде диффузиялық шекаралық қабаттарды бөліп қарастыруға болады. Процестің кезеңдері:
1. Газ көлемінен газдық шекаралық қабат арқылы фазалардың бөліну жазықтығына А компонентінің тасымалдануы (І кезең);
2. Газдан сұйықтыққа бөліну жазықтығы арқылы А тасымаладануы (ІІ кезең);
3. Бөліну жазықтығынан сұйықтықты шекаралық қабат арқылы сұйықтық көлеміне А тасымалдануы (ІІІ кезең);
4. Сұйқтықтағы А және В арасындағы реакция (ІV кезең). Реакция сұйықтық көлеміне негізделген. Реакция өнімдері процестің жылдамдығына және масса тасымалдау параметрлеріне әсер етпейді.
Математикалық модель А компонентінің WIV айналым жылдамдығы және тасымалдау кезеңдеріндегі WI, WII, WIII ағымдарының теңдігіне негізделген: WI = WII = WIII = WIV (16).
Газды шекаралық қабат арқылы тасымал тең: 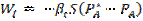 (17), мұндағы
(17), мұндағы 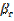 - газ бен фазалардың бөліну жазықтығы арасындағы массаалмасу коэффициенті;
- газ бен фазалардың бөліну жазықтығы арасындағы массаалмасу коэффициенті; 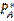 - фазалардың бөліну жазықтығындағы А парциальді қысым; S – фазалардың бөліну жазықтығының ауданы. Сұйықытықты шекаралық қабат арқылы А тасымалы:
- фазалардың бөліну жазықтығындағы А парциальді қысым; S – фазалардың бөліну жазықтығының ауданы. Сұйықытықты шекаралық қабат арқылы А тасымалы: 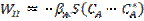 (18), мұндағы
(18), мұндағы 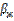 - фазалардың бөліну жазытығы мен сұйық көлемі арасындағы массаалмасу коэффициенті,
- фазалардың бөліну жазытығы мен сұйық көлемі арасындағы массаалмасу коэффициенті, 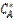 - сұйықтықтағы концентрация.
- сұйықтықтағы концентрация.
Реакция сұйықтықта жүреді және νж көлеміндегі А айналым жылдамдығы тең: 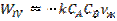 (19). 18 және 19 теңдіктерге 16 теңдікті қойғанда:
(19). 18 және 19 теңдіктерге 16 теңдікті қойғанда:
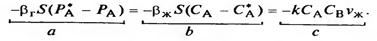 (20).
(20).
a=b теңдеуінен алынады:
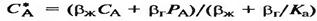 (21), мұндағы Ка – абсорбция константасы.
(21), мұндағы Ка – абсорбция константасы.
5 теңдікті 4 теңдіктен алынған b=c теңдігіне қойғанда:
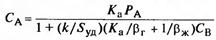 (22), мұндағы Sу –фазалардың бөліну үлестік жазықтығы, Sу = S /νж.
(22), мұндағы Sу –фазалардың бөліну үлестік жазықтығы, Sу = S /νж.
Аққыш орталардан тұратын қозғалмалы жүйеде фазалардың бөліну шекарасы да қозғалмалы, және фазалар арасындағы массаалмасу жағдайын β0 = βSуд сұйықтық көлеміне шаққандағы β0 масса тасымалдау коэффицентін қолдана отырып көлемі бойына орташалайды. Онда сұйық фазадағы А компонентінің концентрациясын 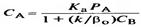 (23) формуласымен көрсетуге болады. Wн бақыланатын айналым жылдамдығын
(23) формуласымен көрсетуге болады. Wн бақыланатын айналым жылдамдығын 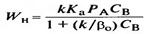 (24) формуласымен есептейді.
(24) формуласымен есептейді.
Негізгі әдебиеттер 1 [197-245], 2 [55-66]
Қосымша әдебиеттер 9 [6,-67]
Бақылау сұрақтары:
1. Химио-технологиялық процестердің негізгі кезеңдері мен заңдылықтары.
2. Өндірістің химиялық кезеңдерінің жіктелінуі.
3. Гомогенді және гетерогенді процестер.
4. Айналымның тең салмақты деңгейі және оны ұлғайту тәсілдері.
№6 Дәріс. Гомогенді және гетерогенді технологиялық процестердің реакция жылдамдықтары. Жылдамдықты ұлғайту тәсілдері. Процестің математикалық моделі.
Гомогенді және гетерогенді технологиялық процестердің реакция жылдамдықтары. Гомогенді деп біртекті ортада жүретін химиялық процестерді атайды, яғни бөлгіш беттері жоқ сұйық немесе газтәрізді қоспаларда. Гомогенді процестің жалпы жылдамдығы химиялық айналымның кинетикасымен анықталады.
Реакцияның м о л е к у л я р л ы ғ ы бойынша моно-, би- және тримолекулярлы, қатары бойынша – нольдік, біріншілік, екіншілік, үшіншілік және бөлшектік қатарлар болып бөлінеді.
Мономолекулярлы реакцияларға молекула ішілік топтар А → D (изомеризлену, инверсия)және ыдырау реакциялары A → D + R жатады.
Бимолекулярлы реакциларқосылу реакциялары А + А → А • А немесе А + В → АВ, ыдырау 2А → D + R және орынбасу(алмасу) А + ВС → АВ + С немесе АВ + CD → АС + BD болып бөлінеді.
Үшмолекулярлы реакцияларсалыстырмалы түред сирек кездеседі; олар әдетте көп кезеңді болады. Үшмолекулярлыға қосылу, алмасу, реконбинация реакциялары болуы мүмкін, яғни сәйкесінше
ЗА → D; 2А + В → D + R и A + B+C→D+R+…
Жауап қайтаратын заттардың концентрацияларының химиялық реакция жылдамдығына әсері жалпы жағдайда келесі теңдеумен сипатталады
u = k∆C,
бұл жерде u G өнімінің, санының өзгерісі арқылы көрсетілуі мүмкін, концентрацияларының немесе уақыт бойынша айналу деңгейлерінің көлемінің өзгеруі арқылы көрсетілуі мүмкін, яғни 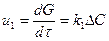 ,
, 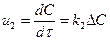 немесе
немесе 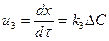 , мұндағы ∆ реакцияның ретіне және қайтымдылығына, араласу деңгейіне байланысьы әр түрлі анықталады.
, мұндағы ∆ реакцияның ретіне және қайтымдылығына, араласу деңгейіне байланысьы әр түрлі анықталады.
А -> В + D схемасы бойынша жүретін бірінші ретті қайтымсыз реакцияның жылдамдығы әсерлесуші заттың концентрациясына тура пропорционалды және 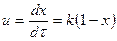 (1), теңдеуімен көрсетіледі, егер процесс периодтық әсерлі ығыстыру реакторларында немесе кез келеген аппаратарда жүзеге асырылатын болса.
(1), теңдеуімен көрсетіледі, егер процесс периодтық әсерлі ығыстыру реакторларында немесе кез келеген аппаратарда жүзеге асырылатын болса.
Бірінші ретті қайтымды реакцияның кинетикалық теңдеуі күрделірек болып келеді, өйеткені тікелей және қайтымды реакцияның жылдамдылығы есептелінеді мысалы, тиоцианат пен тиомочивинаның өзара айналу реакциясы NH4SCN ↔ (NH2)2SC, жалпы түрде 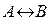 ретінде көрсетуге болады. Реакция біруақытта кері және тікелей бағыттарда жүретіндіктен, онда оның жылдамдығы тікелей және кері реакциялардың жылдамдарының айырымына тең, олардың әрқайсысы мономолякуларлы болып табылады. Идеалды ығыстыру реакторы үшін жылдамдық теңдеуі
ретінде көрсетуге болады. Реакция біруақытта кері және тікелей бағыттарда жүретіндіктен, онда оның жылдамдығы тікелей және кері реакциялардың жылдамдарының айырымына тең, олардың әрқайсысы мономолякуларлы болып табылады. Идеалды ығыстыру реакторы үшін жылдамдық теңдеуі 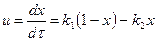 (2) түрінде. Теңбе- теңдік сәтінде теңдік константасы
(2) түрінде. Теңбе- теңдік сәтінде теңдік константасы 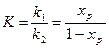 (3). (3) теңдеуін қолдана отырып, тікелей және кері реакциялардың жылдамдықтарының константасын есептеуге болады.
(3). (3) теңдеуін қолдана отырып, тікелей және кері реакциялардың жылдамдықтарының константасын есептеуге болады.
Екінші ретті қайтымсыз реакцияның А + В → С + D жылдамдығы да А және В әсерлесуші заттардың концетрациясына тура пропорционалды. Ығыстыру реакторы үшін 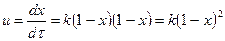 (4).
(4).
Үшінші ретті қайтымсыз реакциялардың жылдамдығы А, В, D үш әсерлесуші заттардың концентрацияларына тура пропорционалды. Егер реагенттер эквиваленттік қатынаста алынса, онда
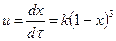 (5). Үшінші ретті реакциялардың аз жылдамдығының нәтижесінде практикалық қолданылуы аз болып келеді.
(5). Үшінші ретті реакциялардың аз жылдамдығының нәтижесінде практикалық қолданылуы аз болып келеді.
Гетерогенді химиялық процестерде бастапқы заттар мен өнімдер әр түрлі фазаларда болады. Газ (сұйық) қатты жүйесінде қатты реагент болып газ немесе сұйық ағындар мен шайылатын кесектік немесе дәндік материал болады. Бөлшектердің беті бірдей қолжетімді. Бөлшектердің мөлшерлері өзгеруі немесе өзгермеуі мүмкін, бастапқы қатты реагенттің орның басатын қатты өнім түзілсе.
Қатты бөлшектердің мөлшерін өзгертетін процестер. Бұның негізінде: Aг + Вт = Rг, реакциясы жатыр, мұндағы г және т компоненттер фазасы.
Процестің құрылымы келесі кезеңдермен көрсетілген: ағыннан беттік жазыққа А реагентін тасымалдау (бірінші І кезең). Сп жазықтығындағы А концентрациясы ағымға қарағанда аз болуы керек; бөлшектің сыртқы бетінде қатты В (ІІ кезең) бар А реакциясы; R өнімін беткі жазықтықтан ағындарға тасымалдау. Реакция жылдамдығы R концентрациясына тәуелді емес және жазықтықтан шығуы процеске әсер етпейді.
Қатты фазада: жазықтықта газтәрізді А мен В реакциясы (ІІ кезең); r бөлшектерінің мөлшерлерін өзгерту, кішірейту (III кезең).
Қатты реагент мөлшері кішіреетін мұндай гетерогенді процестің схемасын «қысушы сфера» деп атайды.
Процестің математикалық моделі: қатты бөлшекте заттардың көлемдік болуы газға қарағанда жүз есе көп. Бөлшектердің мөлшерлерін кішірейту жайырақ жүреді, моно мен шекаралық қабаттағы концентрациялардың таралуы жүреді. Сондықтан уақыттын әрбір сәтінде процестер газдық фазада стационарлық күйде деп есептеуге болады. Стационарлық режимде А заттарының беткі жазықтыққа ағыны (W1 –I кезең) және А әсерлесуінің жылдамдығы (W2 – II кезең) WI = WII тең (2). А ағыны Sr бөлшегінің жазықтығына пропорционалды және С0 ағынында Сп бөлшегінің жазығында А концентрациясының айырмашылығына пропорционалды: 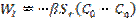 (3), мұндағы β - массалмасу коэффициенті. Жазықтықтағы А айналу жылдамдығы бөлшектің сыртқы жазықтығына пропорционалды:
(3), мұндағы β - массалмасу коэффициенті. Жазықтықтағы А айналу жылдамдығы бөлшектің сыртқы жазықтығына пропорционалды: 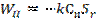 (4). 1 формулаға 3 пен 4 қоя отырып
(4). 1 формулаға 3 пен 4 қоя отырып 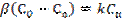 (5) аламыз.
(5) аламыз.
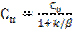 (6) жазықтығындағы А концентрациясы және бақыланатын айналу жылдамдығы
(6) жазықтығындағы А концентрациясы және бақыланатын айналу жылдамдығы 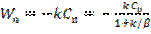 (7). k және β параметрлерінің комбинациясын Кн –жылдамдықтың бақыланатын константасы арқылы белгілейміз:
(7). k және β параметрлерінің комбинациясын Кн –жылдамдықтың бақыланатын константасы арқылы белгілейміз: 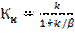 (8). Онда
(8). Онда 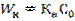 . (9). Тәжірибие жүзінде айналымды хВ қатты затының айналу деңгейі арқылы көрсету қолайлы. Уақытпен бірге айналу деңгейінің өзгерісі:
. (9). Тәжірибие жүзінде айналымды хВ қатты затының айналу деңгейі арқылы көрсету қолайлы. Уақытпен бірге айналу деңгейінің өзгерісі: 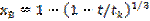 (10).
(10).
Уақыт бойынша бір бөлшектін айналу жылдамдығы келесі формуламен өзгереді: 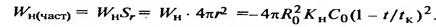 (11), мұндағы R0 бөлшектің бастапқы мөлшері, t – бөлшектін мөлшері r–ге дейін кішерейгендегі уақыт саты, tк – қатты бөлшек толығымен әсерлескендегі уақыт.
(11), мұндағы R0 бөлшектің бастапқы мөлшері, t – бөлшектін мөлшері r–ге дейін кішерейгендегі уақыт саты, tк – қатты бөлшек толығымен әсерлескендегі уақыт.
Қатты бөлшектің мөлшері өзгермей–ақ жүретін процесс. Оның негізінде: 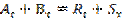 . Реакция бастапқы реагентер мен өнімдерімен қатты фазаларының бөліну шекарасында жүреді және бұл топохимияылқ процесс деп аталады. Мысалы, Н-р, H2S + ZnO = H2O + ZnS, 4FeS2 + 11O2 = 8SO2 + 2Fe2O3.
. Реакция бастапқы реагентер мен өнімдерімен қатты фазаларының бөліну шекарасында жүреді және бұл топохимияылқ процесс деп аталады. Мысалы, Н-р, H2S + ZnO = H2O + ZnS, 4FeS2 + 11O2 = 8SO2 + 2Fe2O3.
Процестің құрылымы келесі кезеңдерден тұрады:
Газтәрізді компонентер үшін:
1. бөлшектің жазықтығынан А компонентінің тасымалдануы (І кезең);
2. ядро жазықтығына инерт қабаты арқылы реагенттің тасымалданыу (ІІ кезең); инерт- борпылдақ материал. Компоненттін тасымалдануы тесіктер арқылы жүзеге асады;
3. ядро жазықтығындағы Вт бірге Аг реакциясы (ІІІ кезең).
Математикалық модель: Стационарлық режимде  ;
; 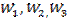 - процестің сәйкес кезеңдеріндегі А ағындары. R0 радиусты бөлшектің жазықтығына А ағыны:
- процестің сәйкес кезеңдеріндегі А ағындары. R0 радиусты бөлшектің жазықтығына А ағыны: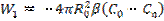 (12) есептелінеді. Инерт қабаты арқылы А тасымалы–
(12) есептелінеді. Инерт қабаты арқылы А тасымалы–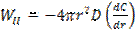 (13) Фика теңдеуімен сипатталатын диффузиялық процесс.
(13) Фика теңдеуімен сипатталатын диффузиялық процесс. 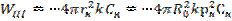 , (14) мұндағы ря – ядроның өлшемсіз радиусы р = r / R0.
, (14) мұндағы ря – ядроның өлшемсіз радиусы р = r / R0.
Wн бақыланатын айналым жылдамдығы мына формуламен есептелінеді: 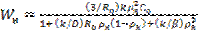 (15).
(15).
1. Газдардың өзара әсерлесуі– фазалардың әсер ету тәсілдері бойынша сұйық өнеркәсіпте бірнеше түрлілігіме көрсетіледі:
2. Барботаж (көпіршік түріндегі диспергерленген газ сұйықтық қабатына көтеріледі);
3. Суландыру (тамшы түріндегі диспергерленген сұйықтық газ арқылы ұшып кетеді);
4. Пленкалы ағын (сұйықтық жазықтық бойынша пленкалы ағады, газ ағыны оның қасынан өтеді);
5. Қондырма колонналарындағы қатынас (ретсіз түрде сұйықтық қондырма бойымен ағады. Газ еркін кеңістікте өтеді);
6. Газсұйықты ағын (газ және сұйықтық ағындары бір бағытта қозғалады).
Процестің құрылымы. Екі фаза да аққыш болғандықтан, фазалардың бөліну шегінде диффузиялық шекаралық қабаттарды бөліп қарастыруға болады. Процестің кезеңдері:
1. Газ көлемінен газдық шекаралық қабат арқылы фазалардың бөліну жазықтығына А компонентінің тасымалдануы (І кезең);
2. Газдан сұйықтыққа бөліну жазықтығы арқылы А тасымаладануы (ІІ кезең);
3. Бөліну жазықтығынан сұйықтықты шекаралық қабат арқылы сұйықтық көлеміне А тасымалдануы (ІІІ кезең);
4. Сұйқтықтағы А және В арасындағы реакция (ІV кезең). Реакция сұйықтық көлеміне негізделген. Реакция өнімдері процестің жылдамдығына және масса тасымалдау параметрлеріне әсер етпейді.
Математикалық модель А компонентінің WIV айналым жылдамдығы және тасымалдау кезеңдеріндегі WI, WII, WIII ағымдарының теңдігіне негізделген: WI = WII = WIII = WIV (16).
Газды шекаралық қабат арқылы тасымал тең: 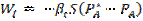 (17), мұндағы
(17), мұндағы 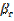 - газ бен фазалардың бөліну жазықтығы арасындағы массаалмасу коэффициенті;
- газ бен фазалардың бөліну жазықтығы арасындағы массаалмасу коэффициенті; 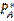 - фазалардың бөліну жазықтығындағы А парциальді қысым; S – фазалардың бөліну жазықтығының ауданы. Сұйықытықты шекаралық қабат арқылы А тасымалы:
- фазалардың бөліну жазықтығындағы А парциальді қысым; S – фазалардың бөліну жазықтығының ауданы. Сұйықытықты шекаралық қабат арқылы А тасымалы: 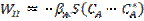 (18), мұндағы
(18), мұндағы 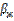 - фазалардың бөліну жазытығы мен сұйық көлемі арасындағы массаалмасу коэффициенті,
- фазалардың бөліну жазытығы мен сұйық көлемі арасындағы массаалмасу коэффициенті, 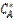 - сұйықтықтағы концентрация.
- сұйықтықтағы концентрация.
Реакция сұйықтықта жүреді және νж көлеміндегі А айналым жылдамдығы тең: 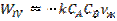 (19). 18 және 19 теңдіктерге 16 теңдікті қойғанда:
(19). 18 және 19 теңдіктерге 16 теңдікті қойғанда:
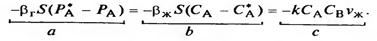 (20).
(20).
a=b теңдеуінен алынады:
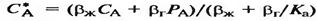 (21), мұндағы Ка – абсорбция константасы.
(21), мұндағы Ка – абсорбция константасы.
5 теңдікті 4 теңдіктен алынған b=c теңдігіне қойғанда:
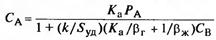 (22), мұндағы Sу –фазалардың бөліну үлестік жазықтығы, Sу = S /νж.
(22), мұндағы Sу –фазалардың бөліну үлестік жазықтығы, Sу = S /νж.
Аққыш орталардан тұратын қозғалмалы жүйеде фазалардың бөліну шекарасы да қозғалмалы, және фазалар арасындағы массаалмасу жағдайын β0 = βSуд сұйықтық көлеміне шаққандағы β0 масса тасымалдау коэффицентін қолдана отырып көлемі бойына орташалайды. Онда сұйық фазадағы А компонентінің концентрациясын 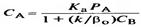 (23) формуласымен көрсетуге болады. Wн бақыланатын айналым жылдамдығын
(23) формуласымен көрсетуге болады. Wн бақыланатын айналым жылдамдығын 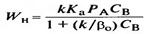 (24) формуласымен есептейді.
(24) формуласымен есептейді.
Негізгі әдебиеттер 1 [-62-78], [53-58]
Қосымша әдебиеттер 9 [6,-67]
Бақылау сұрақтары:
1. Гомогенді процестің лимиттеуші кезеңі қалай аталады?
2. «газ-сұйық», «газ-қатты» гетерогенді процестерін сипаттау үшін қандай кинетикалық модельдер қолданылады?
3. Гетерогенді химиялық процестердің ең басты кинетикалық ерекшелігі қандай?
4. Гетерогенді химиялық процестердің математикалық моделі?
№7 Дәріс. Каталитикалық процестер. Катализдің мәні. Гомогенді және гетерогенді катализ. Қатты катализаторлардың қасиеттері және оларды дайындау.
Катализ деп химиялық реакциялардың жылдамдығын арттыру немесе оларды катализатор қатысында қоздыру, бұл кезде катализаторлар реагентермен аралық химиялық әсерлеседі, бірақ катализдің аяқталысы мен өзінің химиялық құрамын қалпына келтіреді. Реагентер мен катализаторлардың фазалық жағдайының принципі бойынша каталитикалық процестер екі негізгі топқа бөлінеді: гомогенді және гетерогенді.
Катализатор – химиялық реакцияны шапшаңдататын зат, бұл кезде өзі жұмсалмайды. Катализаторлар ретінде м.б. газадар, сұйықтар, қатты заттар қолданылады.
Катализ оң (процесті жылдамдатады) және теріс (процесті тежейді) деп бөледі. Процесті тежейтін катализаторлар ингибитор деп аталады. Катализаторлар әсерлесуші молекулалардың энергетикалық деңгейлерін өзгертпейді тек берілген температурада теңбе- теңдікке жетуді жылдамтады, тікелей және креі реакциялардың жылдамдық константаларын арттырады. Сондықтан теңдік жағдай өзгермейді.
Катализдің мәні реакциялық жолдың өзгерісі немесе катализатордың бастамашы әсері кезінде құнды механизм бойынша реакцияның жүзеге асырылуы нәтижесінде химиялық реакциялардың белсендіру энергиясын түсіруде жатыр.
Реакция катализаторсыз тікелей реакцияға қарағанда, белсендіру энергиясы төмен элементарлық кезеңдердің бірқатары арқылы жүреді.
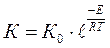
тіпті Еакт азғантай төмендегеннің өзінде реакция жылдамдығы айтарлықтай артады.
А+В=Д+… бимолякулярлы реакциясы катализаторсыз: А+В=АВ*=Д+… схемасы бойынша жүреді (белсенді кешен түзе отырып).
Катализатор қатысында реакция келесі кезеңдер бойынша өтеді:
| А+[кат] =А*[кат] | А*[кат]+В=АВ*[кат] | АВ*[кат]=Д+[кат] |
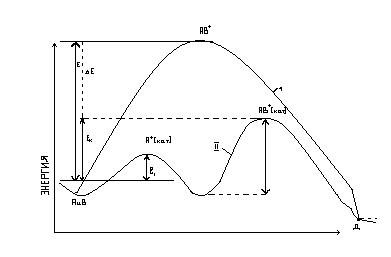
Каталитикалық емес (І) және каталитикалық (ІІ) реакцияларда әсерлесуші жүйелердіңэнергияларының өзгерісі.
Е – каталитикалық емес реакциясының белсену энергиясы; ЕК- каталитикалық реакциясының белсену энергиясы; 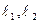 -аралы кезеңдердің белсену энергиясы; ЕК>Е – оң катализ.
-аралы кезеңдердің белсену энергиясы; ЕК>Е – оң катализ.
Катализатордың шапшаңдату әсері оның А белсенділігімен өлшенеді, ол өз кезегінде реакция жылдамдықтарының константаларының катализаторлы Кк және катализаторсызға қатынасымен анықталады К:
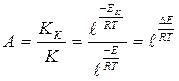
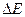 - каталикалық емес пен салыстырғандағы каталикалық реакцияларының төмендеуі:
- каталикалық емес пен салыстырғандағы каталикалық реакцияларының төмендеуі: 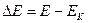 Б, бұл өте көп мөлшерде жылдамдықтың артуына әкеледі. Мысалы,
Б, бұл өте көп мөлшерде жылдамдықтың артуына әкеледі. Мысалы, 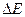 =104 кал/моль, онда Е=600 Ккаталитикалық реакцияның жылдамдығы каталитикалық еместен:
=104 кал/моль, онда Е=600 Ккаталитикалық реакцияның жылдамдығы каталитикалық еместен: 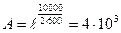 раз есе көп.
раз есе көп.
Әр түрлі катализаторлар әр түрлі деңгейде химиялық реакциялардың жылдамдығын өзгертеді, бұл әдетте Арениус теңдеуімен К0 байланыстырады. Сәйкесінше, катализатор белсенді қатысушы болып табылады, ыдырайтын белсенді кешен түзеді, ал катализатор қайта қалпына келеді. Бірақ тәжірибие жүзінде катализатор бәрібір де өзінің белсендігін сұрыптаушылығын, тұтану температурасын, өнімділігін, тозуға төзімділігін, уландырулығын төмендетеді.
Каталитикалық процестер бөлінеді:
- Тотығу– қалпына келтірушілік өзара әсерлесу;
- Қышқылдық – негіздік өзара әсерлесу;
Каталитикалық процестердің жіктелінуі
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1239; Нарушение авторских прав?; Мы поможем в написании вашей работы!