
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Генные мутации
|
|
|
|
Различают генные мутации, затрагивающие лишь один или несколько нуклеотидов в пределах одного гена, и хромосомные мутации, приводящие к изменению числа хромосом в клетке либо числа или последовательности генов в хромосоме. Рассмотрим сначала генные мутации.
Генные, или точечные мутации возникают, когда последовательность оснований в ДНК гена несколько изменяется и потомству передается новая, искаженная нуклеотидная последовательность. Существуют два основных класса генных мутаций: 1) замены пар оснований, когда одна или несколько нуклеотидных пар в ДНК заменяются другими; 2) мутации со сдвигом рамки считывания, обусловленные вставкой (инсерция) или делецией одного или нескольких нуклеотидов.
Мутации, затрагивающие лишь одну пару оснований и приводящие к ее замене на другую, удвоению или делеции (отсутствию одного нуклеотида ДНК) называют точковыми мутациями.
Замены оснований возникают следующими путями:
1. Замена одного пурина на другой или одного пиримидина на другой – транзиции. Возможны 4 типа транзиций: A↔G, T↔C.
2. Замена пурина на пиримидин и наоборот. Такие замены называют трасверсиями. Он могут быть восьми типов: A↔T, G↔C, A↔C, G↔T.
Тип замены оснований зависит от особенностей мутагенного воздействия и от того, какая последовательность нуклеотидов окружает изменяющееся основание.
В научной литературе спонтанные мутации рассматриваются как побочные продукты нормальных процессов клеточной физиологии. В этой связи необходимо вспомнить концепцию Р. фон Борстела: “мутации возникают в результате ошибок трех «Р»: репликации, репарации, рекомбинации”.
Мутации замены оснований приводит к появлению двух типов мутантных кодонов в мРНК – с измененным смыслом (миссенс) и бессмысленного (нонсенс).
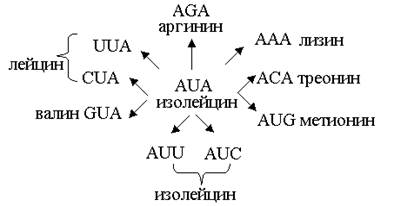 |
Замены пар оснований в нуклеотидной последовательности структурного гена часто приводят к изменению последовательности аминокислот в белке, кодируемом этим геном. Так возникает миссенс-мутации. Однако это происходит не всегда в силу избыточности генетического кода. По таблице генетического кода (табл. № стр. 25) можно определить, что триплет AUA в мРНК кодирует аминокислоту изолейцин. Замена одного основания в первом, втором или третьем положениях кодона может дать девять новых кодонов, два из которых по-прежнему определяют изолейцин, тогда как семь остальных кодируют в совокупности шесть новых аминокислот (рис.).
Рисунок. Точечные мутации.
Из таблицы генетического кода видно, что замены оснований во втором положении триплета всегда приводят к изменению кодируемой аминокислоты (или к образованию сигнала терминации), замены первого нуклеотида триплета почти всегда дают тот же эффект (исключения составляют лишь замены UUA или UUG на GUA или GUG и наоборот, поскольку все эти триплеты кодируют литцин, а также замены AGA и AGG на CGA или CGG и наоборот, так как все эти триплеты кодируют аргинин). Однако замена третьего нуклеотида триплета часто не вызывает изменения его смысла, поскольку большая часть избыточности генетического кода относится именно к третьему основанию триплета. Триплеты, кодирующие одну и ту же аминокислоту, называется синонимами.
Следовательно, так как код вырожденный, не всякая мутация в кодоне приводит к замене аминокислоты (нейтральная мутация). Не всякая замена аминокислоты отразится на функциональной активности белка. Поэтому в обоих случаях ситуация останется не выявленной. Это объясняет, почему частоты мутаций в данном гене и встречаемость мутантов по нему могут не совпадать. Хотя в ряде случаев миссенс-мутация может иметь серьезные последствия для организма (например, появление гемоглобина S при серповидноклеточной анемии у человека). Гемоглобин S – вариант нормального гемоглобина А, состоящий из двух идентичных a-цепей и двух идентичных b-цепей. Лица, гомозиготные по мутантному аллелю, кодирующему синтез аномальной b-цепи, страдают тяжелой формой гемолитической анемии. В условиях недостатка кислорода гемоглобин S образует кристаллоподобные сцепления, нарушающие морфологию эритроцитов. Они удлиняются, принимая серповидную форму, аномальные клетки могут закупорить мелкие сосуды и прекратить доступ кислорода к тканям. Сравнение аминокислотных последовательностей b-цепей гемоглобинов А и S показало, что различие между ними определяется заменой только одной аминокислоты.
По характеру влияния на активность ферментов различают несколько типов миссенс-мутаций: растекающиеся (ликовые), снижающие уровень синтеза или образования менее активных ферментов; с нормальной активностью в одних условиях и слабоактивные в других (условно летальные мутации) и др.
К типу «нонсенс» относятся мутации, приводящие к замене пар оснований, при которой кодон, определяющий аминокислоту, превращается в один из нонсенс кодонов, не транслирующихся на рибосомах. Появление такого кодона не в конце структурного гена, а внутри него, приводит к преждевременной терминации трансляции, т.е. к обрыву полипептидной цепи и сопровождается полным выключением функции фермента.
Такие замены переводят триплет, кодирующий ту или иную аминокислоту, в триплет-терминатор, и наоборот (например, мутация, вызывающая в мРНК изменение триплета UAU, кодирующего тирозин, - в триплет UAA, который служит терминирующим сигналом). Замены такого типа приводят к образованию белковых молекул с более короткими полипептидными цепями, поскольку после терминирующего сигнала считывание (трансляция) нуклеотидной последовательности прекращается.
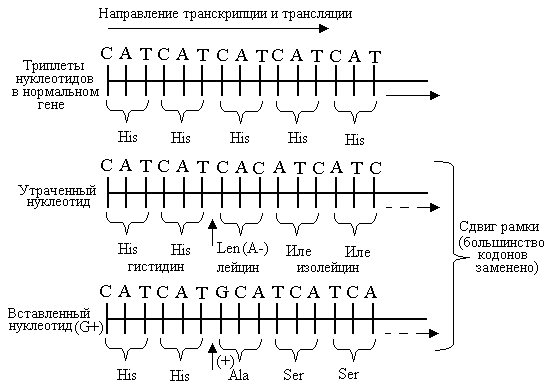 |
Мутации со сдвигом рамки считывания (фреймшифт) обусловлены вставками или выпадениями одного или нескольких нуклеотидов, и часто сильно изменяют последовательность аминокислот в транслируемом белке.
Рисунок. Мутации со сдвигом рамки считывания вследствие утраты нуклеотида (А -) и включения (вставки) нуклеотида (G +).
Вставка или делеция одного или нескольких оснований (их число не должно быть кратно трем) сдвигает «рамку считывания» нуклеотидной последовательности, начиная от точки, где произошла вставка или делеция, и до конца молекулы (рис.).
Если в каком-то месте нуклеотидной последовательности возникла вставка одной нуклеотидной пары, а в другом месте – делеция одной пары, то исходная рамка считывания, а значит, и правильная последовательность аминокислот восстанавливается после этой второй мутации.
Мутация может касаться как структурных, так и регуляторных генов. Структурные изменения ДНК заключаются в разрыве одной или нескольких цепей, образовании диметров, появлении поперечных сшивок.
Различают спонтанную и индуцированную мутацию. Генные мутации могут возникать спонтанно вследствие молекулярных процессов, как связанных, так и не связанных с репликацией ДНК. Индуцированная мутация возникает под влиянием факторов внешней среды.
Мутагенные факторы (мутагены) – различной природы факторы, естественное наличие или искусственное применение которых вызывает появление мутаций.
Естественный мутагенез основан на действии автомутагенов (мутагенных факторов, возникающих в организме в процессе обмена веществ и способных вызывать генные и хромосомные мутации), генов-мутаторов и ряда природных факторов, включая экстремальные внешние условия. Однако частота спонтанного мутирования низка.
Мутагены, способные вызывать индуцированные мутации, делятся на физические, химические и биологические. Физические мутагены включают различные излучения, температуру, ультразвук и механические воздействия. Среди них лидирующее положение занимают ионизирующее и ультрафиолетовые излучения. К ионизирующему излучению относятся электромагнитные (рентгеновские, гамма-лучи) и корпускулярные радиоактивные излучения (электроны или b-частицы; протоны или a-частицы, нейтроны).
Действие ионизирующего излучения основано на образовании ионов в облученной ткани (первичное действие) и тепловом возбуждении молекул этой ткани (вторичное действие), вследствие чего пораженные молекулы претерпевают химические изменения, влекущие за собой генетические последствия. Ультрафиолетовые лучи производят только возбуждение молекул; проникающая способность их невелика и они являются причинами мутации лишь в соматических клетках. Если мутация произошла в соматической клетке, то последствия связаны лишь с судьбой данного организма. С его гибелью исчезают следы произошедшей мутации. Ионизирующие излучения способны вызывать мутации в половых клетках (гаметах). Если мутация произошла в гамете и яйцеклетка оплодотворилась, то последствия мутации сказываются на судьбе потомства. Таким образом, облучение способно изменить наследственность гамет и вызвать мутации в такой минимальной дозе радиации, которая не вызывает гибель или лучевое поражение организма. Потомство облученного при этом находится под угрозой развития наследственной болезни.
Установлено, что ионизирующие излучения индуцируют мутации рандомизированно как по отдельным хромосомам, так и по их длине. Инфракрасное излучение само по себе не способно вызывать повреждение генетического аппарата клеток, но в сочетании с ионизирующим усиливает мутагенный эффект.
Химические мутагены чаще повреждают гетерохроматиновые участки хромосом и в зависимости от принципа действия разграничиваются на пять групп: 1) цитостатические препараты, особенно ингибиторы азотистых оснований нуклеиновых кислот (теобромин, теофиллин и др.); 2) аналоги азотистых (пуриновых, пиримидиновых) оснований, включающиеся вместо них в нуклеиновые кислоты; 3) алкилирующие соединения (азотистый иприт, фенол, формальдегид); 4) окислители, восстановители и свободные радикалы; 5) акридиновые красители.
Наибольшей мутабильностью обладают алкилирующие соединения: этиленилены, диэтилсульфат, 1,4 бисдиазоацетилбутан, этилметансульфонат, N-нитрозоалкилмочевина и ряд других.
К биологическим мутагенам относятся вирусы, поражающие как соматические, так и половые клетки (вирусы краснухи, цитомегалин, гепатита В). Например, у женщин, перенесших краснуху или вирусный гепатит, наблюдаются спонтанные аборты, причем в клетках плода отличаются многочисленные хромосомные аберрации. У потомства таких женщин чаще встречаются хромосомные болезни.
Чувствительность клеток к мутагенам неодинакова в разных фазах клеточного цикла. Ионизирующие излучения наиболее эффективны при действии на стадии G2 –фазы, а большинство химических мутагенов - G1-S-фазы.
Мутагенное воздействие, достигнув мишени, вызывает первичное повреждение: одно- и двунитевые разрывы ДНК; перекрестные сшивки ДНК – ДНК и ДНК – белок, алкилирование оснований и сахарофосфатного остова молекулы ДНК, образование пиримидиновых димеров.
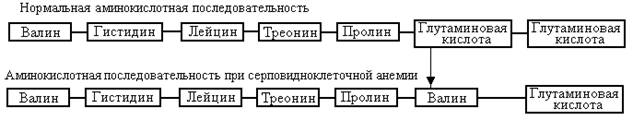
Генные мутации оказывают на организм самое различное воздействие: от едва заметного и пренебрежимо малого до летального. Замены пар оснований, не приводящие к изменению аминокислотной последовательности кодируемого белка, если и влияют, то лишь незначительно на способность организма нормально функционировать и размножаться. Мутации, при которых изменяются одна или даже несколько аминокислот, также могут либо совсем не оказывать на организм никакого видимого вредного влияния, либо воздействовать на него лишь в слабой степени, если эти замены не затрагивают основных биологических функций кодируемого белка. Однако последствия замены одной – единственной аминокислоты могут быть очень существенными, если эта аминокислота входит в состав активного центра фермента или каким-либо иным образом влияет на биологически важные функции кодируемого белка (рис.).
Рисунок. Первые семь аминокислот в b - цепи гемоглобина человека. b - цепь состоит из 146 аминокислот. Замена глутаминовой кислоты валином в шестом положении ответственна за тяжелое наследственное заболевание – серповидноклеточную анемию.
Вред, причиняемый организму мутациями, часто зависит от конкретных внешних условий. Например, у людей при гомозиготности по одной из рецессивных мутаций возникает тяжелая болезнь фенилкетонурия (ФКУ) однако лица, гомозиготные по этой мутации, могут, тем не менее, нормально существовать на диете, при которой исключен фенилаланин, поскольку все проявления этой болезни связаны с неспособностью организма усваивать данную аминокислоту.
Антимутагенез. Репарация ДНК.
Не все первичные повреждения реализуются в мутации, этот процесс многоступенчатый и главное событие в нем – репарация ДНК.
Следствием ошибок репарации или ее отсутствия является «закрепление» мутации. Нужно помнить, что подавляющее большинство мутаций не имеет последствий для организма по той причине, что только 5 % всех генов функционируют в организме на данном этапе онтогенеза, остальные находятся в репрессивном состоянии и не транскрибируются.
Различают три основные возможности формирования предмутационных повреждений ДНК и возникновения мутаций:
1. мутаген может включиться в ДНК вместо нормального основания (например, 2-аминопурин, являющийся аналогом аденина, встраиваясь в ДНК, спаривается с тимином или цитозином, что приводит к возникновению транзиций типа AG ® GC и GC ® AT).
2. мутаген может сам не встраиваться в ДНК, но так модифицировать основания, что в ходе последующей репликации произойдет их ошибочное спаривание.
3. мутаген может, повредит одно или несколько оснований, затрудняя или делая невозможным их спаривание с обычным основанием.
Репарация – самовосстановление первичной структуры ДНК, следующее после нарушения ее физическими и химическими мутагенами.
Все известные в настоящее время способы репарации ДНК обеспечиваются постоянно действующими или индуцируемыми ферментами, удаляющими повреждения, возникшие в одной из цепей ДНК. Некоторые способы могут не вполне точно восстанавливать исходную последовательность оснований в ДНК, вследствие чего возникают мутации.
Возможность репарации ДНК была обнаружена в 1949 году, когда три автора – А. Кёльнер, Р. Дюльбенко и И. Ф. Ковалев – независимо друг от друга установили, что освещение видимым светом (с длиной волны свыше 400 нм) актиномицетов, бактериофага и парамеций восстанавливает их жизнеспособность после УФ – облучения в летальных дозах. Это явление названо фотореактивацией. Оно происходит вследствие активации фотореактивирующего фермента, расщепляющего димеры пиримидинов и восстанавливающего первичную структуру ДНК.
Основные механизмы репарации ДНК и ферменты, обеспечивающие этот процесс, были раскрыты к концу 70-х годов.
Для клеток млекопитающих и человека выявлено много типов репарации, которые осуществляются на разных стадиях клеточного цикла. Они отличаются, друг от друга не только по времени протекания, но и эффективностью. Если невозможна прямая реактивация, то работают механизмы эксцизионной репарации. Эксцизионная (темновая) репарация, протекающая в пресинтетической стадии (G1) клеточного цикла, обладает высокой эффективностью. Она осуществляется путем «вырезания» эндонуклеазами поврежденных участков ДНК (димеров пиримидинов) и и последующего восстановления образующейся бреши с помощью ферментов ДНК - полимериз I и II - новыми нуклеотидами комплементарно к непораженной нити этой же молекулы ДНК. Практически все повреждения молекулы ДНК при этом могут полностью репарироваться без образования мутаций.
Если молекула ДНК с димерами реплицируется, против каждого из ее димеров образуется брешь. Последующий обмен между сестринскими полинуклеотидными цепями может восстанавливать первичную структуру молекулы ДНК. Такой тип репарации ДНК называется рекомбинационной (пострепликационной) репарацией.
Эта репарация осуществляется в тех случаях, когда повреждения в цепях ДНК по тем или иным причинам не были устранены до начала репликации. Последствия таких повреждений могут быть сведены к минимуму благодаря этому типу репарации. Иногда при нарушении пострепликативной репарации в противоположность эксцизионной возникают ошибки и как следствие образуются мутации. Например, один из типов пигментной ксеродермы у людей (XPVAR) связан с блоком пострепликативной репарации. Высокую частоту хромосомных аберраций, наблюдающихся в случае рецессивной болезни у человека – синдрома Блума, также объясняют нарушением рекомбинационной репарации.
Мутация может касаться генов контролирующих ферменты репарации ДНК. В таких случаях повышается чувствительность организма к лучевым и другим мутагенным воздействиям. Злокачественный рост, преждевременное старение, коллагенозы имеют в патогенезе именно такие механизмы.
Известны мутантные формы эукариот с ослабленным неплановым синтезом ДНК и поэтому с повышенной чувствительностью к УФ излучению и другим мутагенным факторам. Некоторые люди, гомозиготные по мутантному гену пигментной ксеродермы (xeroderma pigmentosum), проявляют повышенную чувствительность к солнечному свету, склонны к аномальной пигментации кожи и к заболеванию кожным раком. Известно несколько разных генетических форм этой болезни, и, по крайней мере, некоторые из них объясняются неспособностью клеток к вырезанию тимидиновых димеров. Например, пигментная ксеродерма I (XPI) сопровождается чувствительностью клеток больных людей к действию УФ излучения в связи с их дефектностью по УФ – эндонуклеазе – ферменту, который первым распознает тимидиновые димеры и некоторые другие повреждения.
Репарация всегда осуществляется в первом после воздействия цикле. Наряду с антимутационным механизмом репарации обнаружены вещества, предупреждающие или снижающие действие мутагенов, а также уровень естественного мутирования. Такие вещества называются антимутагенами. Постоянно присутствующие в организме естественные антимутагены входят в единую буферную систему, удерживающую частоту спонтанного мутирования на естественном для вида уровне. Обнаружено, что антимутагенный эффект имеют: фермент каталаза, хлорофилл, пироксидаза капусты, витамины А и С (при одновременном употреблении обеспечивают устойчивость организма к действию γ-облучения), витамин Е, интерферон.
Вещества, снижающие генетическое и физиологическое действие радиации, называют радиопротекторами. Например, ультрафиолетовое облучение сразу после облучения лучами Рентгена снижает радиогенетическое действие последних. Действие ряда химических радиопротекторов (цистеамина, стрептомицина и др.) объясняется миграцией на их молекулы части энергии, поглощенной хромосомами во время облучения, вследствие чего частота мутаций понижается. Действие гипосульфита и некоторых других веществ основано на химическом связывании кислорода клетки и создании, таким образом, условий гипоксии, ведущих к снижению радиогенетического эффекта. Такое явление называется кислородным эффектом.
Кислородный эффект – изменение частоты индуцируемых радиацией (за исключением α-лучей и нейтронов) мутаций с изменением концентрации кислорода в среде. Он универсален, наблюдается при облучении растений, бактерий, животных. При полном отсутствии кислорода (аноксия) в среде радиоустойчивость клеток повышается в 2 – 3 раза. Сенсибилизирующий эффект кислорода возрастает до концентрации его в 21 %, характерной для атмосферы. Последующее повышение концентрации кислорода уже не увеличивает радиогенетического эффекта облучения.
|
|
|
Дата добавления: 2014-01-04; Просмотров: 6215; Нарушение авторских прав?; Мы поможем в написании вашей работы!