
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы получения
|
|
|
|
Физические свойства
| № | Название оксосоединения | Агрегатное состояние | t- пл., 0С | t-кип., 0С | Относительная плотность, d420 |
| метаналь | газ | -118 | -19 | 0,815 | |
| этаналь | жидкость | -123 | 0,778 | ||
| пропаналь | жидкость | -81 | 0,807 | ||
| пропанон-2 | жидкость | -95 | 0,792 | ||
| бутанон-2 | жидкость | -86 | 0,805 | ||
| бензальдегид | жидкость | -26 | 1,048 |
1. Окисление спиртов.
Первичные спирты окисляются до альдегидов, вторичные – до кетонов. В качестве окислителей первичных и вторичных спиртов используются: хромовая смесь (бихромат калия в серной кислоте), перманганат калия в щелочной среде.
1.1. Окисление первичных спиртов.
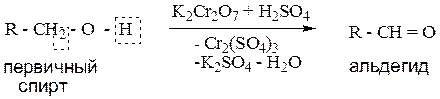
Пример:
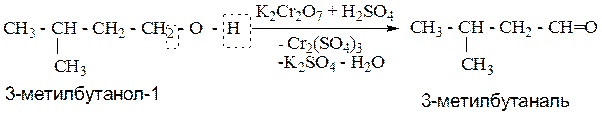
1.2. Окисление вторичных спиртов.
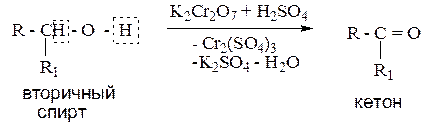
Пример:

2. Дегидрирование спиртов.
При пропускании паров спирта над катализатором (соединения меди, серебра, хрома или цинка), при нагревании происходит отщепление двух атомов водорода. Первичные спирты образуют альдегиды, вторичные – кетоны.
2.1. Дегидрирование первичных спиртов.
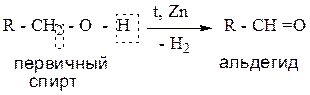
Пример:
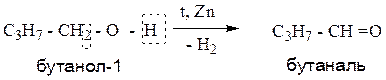
2.2. Дегидрирование вторичных спиртов.

Пример:

3.Оксосинтез.
Данный способ служит для получения только альдегидов. Исходное соединение алкен берется на один атом углерода меньше, чем получаемый альдегид. Одновременно образуются два изомера. Реакция протекает при нагревании, с участием катализатора. Образующиеся из смеси водород и альдегидная группа попеременно присоединяются к различным атомам углерода по разрыву двойной связи.

Пример1:

Пример 2:
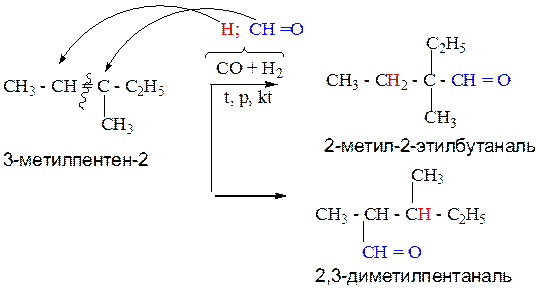
4. Гидролиз геминальных дигалогенопроизводных.
В геминальных дигалогенопроизводных атомы галогена расположены у одного атома углерода. Данный способ позволяет получить все оксосоединения. Реакция идет через стадию образования двухатомных спиртов.
|
|
|

Пример1:
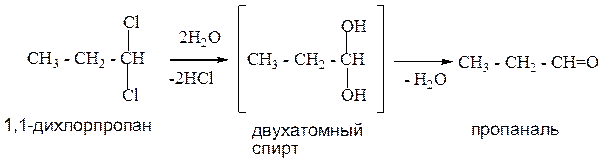
Пример 2:
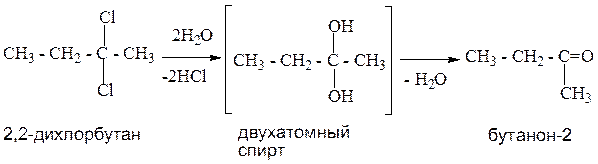
5. Пиролиз (сухая перегонка) кальциевых (бариевых) солей карбоновых кислот.
Данный способ позволяет получить все оксосоединения. Протекает при нагревании.
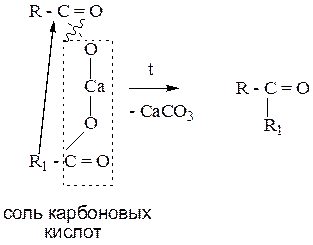
Пример 1:
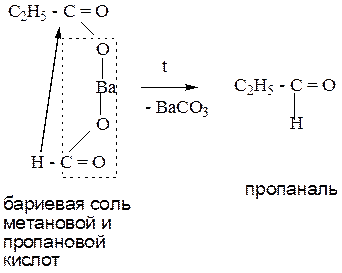
Пример 2:
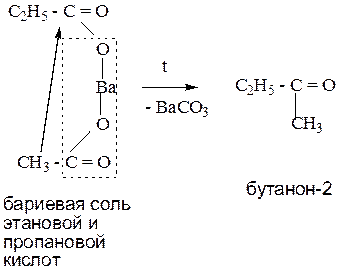
6.Восстановление производных карбоновых кислот.
При действии на галогенангидриды, амиды, сложные эфиры карбоновых кислот восстановителей (комплексные гидриды металлов и др), происходит образование альдегидов.
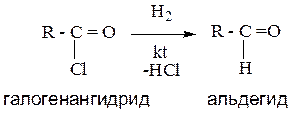
Пример:
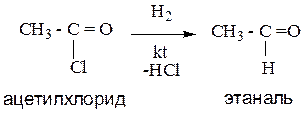
7. Гидратация алкинов (реакция Кучерова).
При взаимодействии алкинов с водой происходит образование промежуточного продукта – енола (непредельного одноатомного спирта), который, путем последующей перегруппировки, образует кетон. Исключение составляет ацетилен, который в данной реакции образует уксусный альдегид. Реакция протекает в кислой среде, в присутствии солей ртути.

Пример 1:
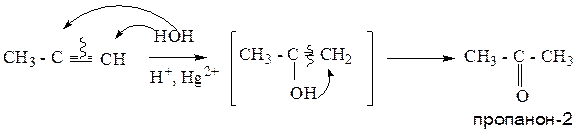
Пример 2:
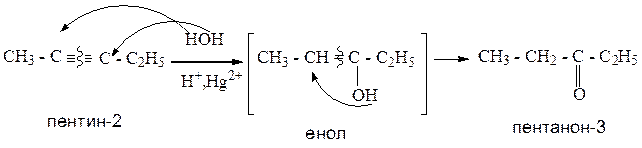
Пример 3 (для ацетилена):

8. Получение п-толуилового альдегила (реакция Гаттермана–Коха).

9. Ацилирование бензола (реакция Фриделя – Крафтса).
Реакция получения ароматических кетонов (подробно разбиралась в теме «Арены»,химические свойства).
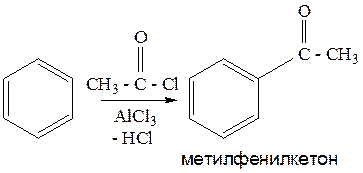
Строение молекулы альдегида, гибридизация.
Атомы углерода и кислорода в карбонильной группе находятся в состоянии sp2-гибридизации. Углерод своими sp2-гибридными орбиталями образует 3 s-связи (одна из них - связь С–О, и две связи С - R), которые располагаются в одной плоскости под углом около 120° друг к другу. Одна из трех sp2-орбиталей кислорода участвует в s-связи С–О, две другие содержат неподеленнные электронные пары. π-cвязь образована р -электронами атомов углерода и кислорода.

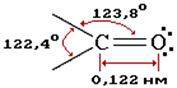
Связь «С = О» в молекуле оксосоединения поляризована, т.е. смещена к кислороду, вследствие большей электроотрицательности последнего. На кислороде возникает избыток электронной плотности (δ- заряд); на атоме углерода -недостаток электронной плотности (δ+ заряд).
|
|
|
Исходя из выше изложенного, можно сделать следующие выводы:
1. Наличие ненасыщенной связи С = О, говорит о протекании реакций присоединения (А).
2. Атом углерода оксогруппы недостаток электронной плотности стремится восполнить за счет отрицательно заряженной нуклеофильной частицы. Следовательно, присоединение нуклеофильное (АN).

3. Так как оксогруппа является акцепторной группой, т.е. смещает электронную плотность в свою сторону, электронная плотность по связи «С-Н» у α-углеродного атома, смещается в сторону последнего, и водород приобретает подвижность и способен отщепляться в виде протона. Следовательно, для оксосоединений характерны реакции электрофильного замещения (SЕ).
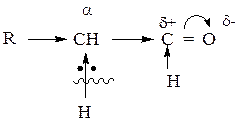
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 929; Нарушение авторских прав?; Мы поможем в написании вашей работы!